Darmbacteriën hebben we hard nodig. In de eerste levensjaren leert ons afweersysteem onschadelijke darmbacteriën te herkennen en te tolereren. Die tolerantieontwikkeling verloopt echter niet bij iedereen even goed. Dit kan leiden tot ontsteking van de darmen.
Darmbacteriën hebben we hard nodig voor de vertering van ons voedsel en voor de bescherming tegen ziekteverwekkers. In de eerste levensjaren leert ons afweersysteem deze onschadelijke darmbacteriën, de commensalen, te herkennen en te tolereren. Die tolerantieontwikkeling verloopt echter niet bij iedereen even goed, waardoor de afweercellen commensalen soms gaan zien als schadelijk. Dit kan leiden tot ontsteking van de darmen.
Omdat je darmbacteriën niet weg kunt halen – in onze darm leven naar schatting 3,8 × 1013 bacteriën – hebben mensen die hun eigen darmbacteriën niet verdragen, een darmontsteking die eigenlijk nooit over gaat. Deze ziekte heet daarom ‘chronische darmontsteking’ maar wordt veelal met de Engelse term Inflammatory Bowel Disease (IBD) aangeduid.
De intolerantiefouten verschillen van patiënt tot patiënt en kunnen zich zowel in het aangeboren als in het verworven afweersysteem bevinden. Als gevolg hiervan verschilt de ziekte ook van patiënt tot patiënt en zit soms overal in de darm of soms alleen op één plek.
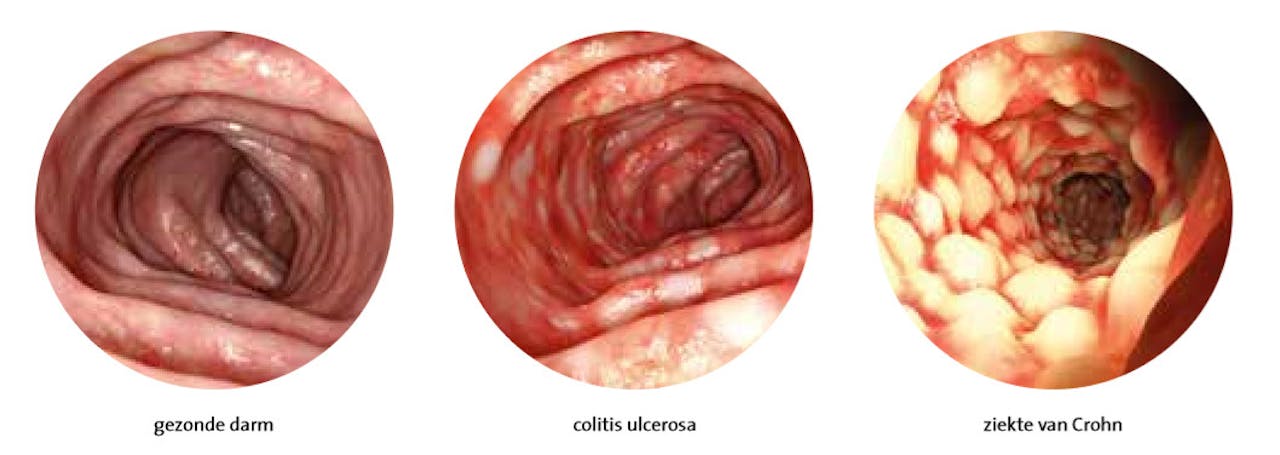
Momenteel worden er op basis van de plaats van de ontsteking en de microscopische kenmerken – welke celtypen zitten in de ontsteking en hoe is het weefsel beschadigd – twee klinische vormen van de ziekte onderscheiden: de ziekte van Crohn en colitis ulcerosa. Alle patiënten die niet in deze twee groepen passen, hebben ‘niet geclassificeerde IBD’. Om te begrijpen wat er het mis gaat, eerst iets over de normale ontwikkeling van het afweersysteem in de darm.
Normale ontwikkeling tolerantie
Direct na de geboorte wordt de darm voor het eerst gekoloniseerd met bacteriën. In de eerste jaren leren het aangeboren en het verworven darmafweersysteem de onschadelijke bacteriën kennen, herkennen en onderscheiden van de schadelijke soorten.
De slijmvliescellen in de darm, de epitheelcellen, zijn de eerste cellen die contact maken met de bacteriën. Ze behoren tot het aangeboren afweersysteem. De epitheelcellen zijn nauw met elkaar verbonden en vormen zo een eerste fysieke barrière tegen indringers. Daarnaast hebben epitheelcellen verschillende receptoren op hun celoppervlak waarmee ze bacteriën aan hun moleculaire structuren kunnen herkennen, zoals suikerketens of vetten op de bacteriewand. Dit is een biochemisch proces: een bacteriële suikerketen bindt bijvoorbeeld aan een receptor op de epitheelcel.
Na de herkenning van een bacteriële structuur, maakt de epitheelcel een ontstekingsstof. Hiermee roept het witte bloedcellen van het aangeboren afweersysteem op om vanuit de bloedbaan het darmweefsel binnen te komen. Daar aangekomen kunnen de witte bloedcellen heel effectief ziekteverwekkende bacteriën opnemen en afbreken door ze eerst geheel te omsluiten, en vervolgens in de cel op te nemen en te verteren. Dit heet fagocytose (zie ook het artikel over ons afweersysteem).
Bij elk eerste contact met bacteriën – of ze nu schadelijk zijn of niet – maken de darmepitheelcellen ontstekingsstoffen. Bij afwezigheid van ‘signalen van gevaar’, zoals giftige moleculaire structuren van een ziekteverwekker, past de epitheelcel zich bij elk volgend contact een beetje aan door steeds minder heftig te reageren. De herhaalde herkenning van onschadelijke bacteriën zorgt dat de epitheelcel zijn ‘volumeknop’ zachter zet en minder ontstekingsstoffen maakt. Zo ontstaat tolerantie voor commensalen en hebben we niet continu last van darmontstekingen.
De epitheelcellen blijven wel alert en reageren nog steeds op ‘signalen van gevaar’ wanneer bijvoorbeeld een ziekteverwekkende Salmonella in de buurt komt die wel giftige moleculaire structuren heeft. Deze structuren geven via de receptoren op de epitheelcel een veel krachtigere alarmerende combinatie van ontstekingsstoffen waardoor de Salmonella snel verwijderd zal worden door de opgeroepen fagocyten.
Wereldwijd lijden 5 miljoen mensen aan chronische darmziekten.
ShutterstockElkaar leren kennen
In de eerste levensjaren leert ook het verworven afweersysteem de commensale bacteriën kennen. T-cellen kunnen met hun receptor bacteriële antigenen uiterst precies herkennen. Wanneer een bacterie voor het eerst in het lichaam komt, duurt het dagen tot weken voordat deze antigeenspecifieke T-cellen zijn aangemaakt. Echter, als dit eenmaal gebeurd is, worden er T-geheugencellen gevormd die een antigeenspecifieke receptor bezitten en in het darmweefsel patrouilleren. Wanneer patrouillerende cellen een ziekteverwekker opnieuw ontdekken, is de afweerreactie snel, precies en effectief. Dit zijn de ontstekingsbevorderende T-cellen. Zij kunnen cellen doden waarin schadelijke bacteriën of virussen zijn gaan nestelen, en zetten fagocyten aan tot meer actie.
Naast de ontstekingsbevorderende T-cellen zijn er ook ontstekingsremmende, regulerende T-cellen. Deze regulerende T-cellen vormen het geheugen voor wat onschadelijk is en onderdrukken juist als ‘scheidsrechters’ ongewenste reacties van andere afweercellen als er onschadelijke commensalen of voedingseiwitten het lichaam binnenkomen. In de eerste levensjaren ontwikkelt het darmafweersysteem ook een leger van regulerende T-cellen, die de commensalen herkennen en ongewenste reacties van andere afweercellen op deze goedaardige bacteriën onderdrukken.
Iedere persoon zijn eigen vijanden
Niet iedereen blijkt gekoloniseerd te zijn met dezelfde bacteriesoorten. Dat hangt onder meer af van de genetische aanleg, de werking van ons afweersysteem en het voedingspatroon. Op dit moment wordt er veel onderzoek gedaan naar de factoren die deze persoonsgebonden ‘keuze’ in commensalen bepalen en hoe dit de werking van het afweersysteem beïnvloedt. Ook wordt er onderzocht welke fouten het afweersysteem van een IBD-patiënt maakt.
Uit genetische analyses van ongeveer 75.000 patiënten zijn ongeveer 160 gengebieden (waarin zich meerdere genen bevinden) gevonden die een genetische aanleg voor IBD zouden kunnen veroorzaken. Van deze gengebieden is een groot deel betrokken bij afweerreacties van fagocyten, T-cellen en epitheelcellen. Er zijn aanwijzingen dat sommige van deze gengebieden zelfs in gezonde individuen de persoonsgebonden ‘keuze’ van commensalen bepalen. Deze genen maken iemand gevoelig, maar er is meer nodig om chronische darmontsteking te ontwikkelen.
Een tweede factor die een rol speelt bij deze darmziekte zijn de commensale bacteriën. Uit heel grote kolonisatiestudies, met soms wel 1000 patiënten, is gebleken dat IBD-patiënten andere darmcommensalen hebben dan gezonde mensen. Bepaalde groepen bacteriën met beschermende eigenschappen zijn afwezig in IBD-patiënten terwijl andere bacteriesoorten die vaker ontsteking veroorzaken juist meer aanwezig zijn.
Hoe de samenstelling van de commensalen uit balans raakt en of dit een oorzaak is van de ziekte of juist een gevolg, is nog niet duidelijk. Het is technisch heel lastig te bewijzen welke bacteriën de ziekte chronisch maken, omdat iedereen zowel persoonsgebonden commensalen heeft als eigen gevoeligheidsgenen en daardoor een andere vorm van de ziekte. Iedereen heeft zogezegd zijn eigen vijanden.
Onderzoekers gaan daarom meten hoe het afweersysteem op bacteriën reageert. Gaat bijvoorbeeld de volumeknop op de epitheelcel niet op zacht, zijn de fagocyten veel te actief, is er een receptor kapot, of maakt de darm niet genoeg regulerende T-cellen aan? Deze afweerreacties zijn onafhankelijk van de precieze bacteriestam. Metingen van deze afweerreacties kunnen in de toekomst misschien helpen om IBD niet meer alleen onder te verdelen in de ziekte van Crohn of colitis ulcerosa maar in ‘afweerfouten’ waarop een therapie is af te stemmen.
Behandeling
Alle mensen met IBD worden nu behandeld met medicijnen die de ontsteking in de darm remmen. Deze medicijnen remmen de T-cellen en soms ook de fagocyten. De meesten hebben hier baat bij, maar sommigen niet. Bij hen blijven de afweercellen de darm beschadigen. Crohn-patiënten kunnen tijdelijk een behandeling met sondevoeding of drinkvoeding krijgen. Deze kunnen heel effectief zijn, maar ook erg belastend.
Wanneer al deze medicijnen niet werken, is het mogelijk om mensen te behandelen met antistoffen tegen de ontstekingsstof TNF-alfa (tumornecrosefactor-alfa) die zowel door fagocyten als T-cellen gemaakt wordt. Maar ook hierop reageert niet elke IBD-patiënt even goed. Veel farmaceutische bedrijven werken daarom momenteel aan de ontwikkeling van nieuwe medicijnen tegen darmontsteking.
Wanneer de ontsteking niet goed geremd wordt, veroorzaakt dit steeds meer schade en moet men uiteindelijk geopereerd worden om het beschadigde stuk darm te verwijderen. Eén van de belangrijkste doelen van onderzoek is daarom het begrijpen welk afweerproces de ziekte veroorzaakt in het individuele geval. Inzicht in het achterliggende mechanisme is nodig om te voorspellen welke patiënt op welke medicijnen goed gaat reageren en bij wie de ziekte snel erger wordt.

