Zoals wij een Ikea-kast in elkaar zetten, zo bouwt een cel machines: vanuit losse onderdelen en met behulp van gereedschappen. Als een vakman neemt de cel het erg nauw bij het in elkaar timmeren van de onderdelen, benadrukken celbiologen van de Kansas State University.
Eiwitten verzetten bergen werk in een cel, zoals het omzetten en transporteren van allerlei stoffen. Om gezond te blijven ruimt een cel overbodige en beschadigde eiwitten op. Voor die klus heeft hij moleculaire vuilniswagens klaarstaan, de proteasomen. Eiwitten die weg moeten krijgen een chemisch vlaggetje opgespeld waaraan het proteasoom ze herkend als afval. De vuilniswagen komt langs om de gemarkeerde eiwitten op te pikken en af te breken.
Een proteasoom bouwen is een ingewikkelde klus voor de cel. Het moleculaire machientje bestaat uit 66 onderdelen die op de juiste manier bij elkaar moeten komen. Het proces wordt gecoördineerd door helpereiwitten. Wetenschappers van Kansas State University ontrafelden een belangrijke stap in de assemblage van het proteasoom, zo is deze week te lezen in Nature Communications.
Ikea-bouwpakket
De Nederlandse celbioloog Jeroen Roelofs, die studeerde aan de Rijksuniversiteit Groningen, leidde de studie. “Het proces lijkt op de assemblage van meubels”, legt hij uit. “Als je een ladekast koopt bij Ikea krijg je een stapel onderdelen die je met behulp van gereedschappen in elkaar moet zetten voordat je een functionele kast hebt.”
“De cel hanteert hetzelfde concept. Er is een stapel onderdelen en helpereiwitten hebben de functie van gereedschap. Ze assisteren bij het in elkaar zetten van de onderdelen tot grotere onderdelen, die vergelijkbaar zijn met de laden van de kast. Die grotere onderdelen worden vervolgens samen gebracht om het eindproduct te maken: het proteasoom.”
Schild
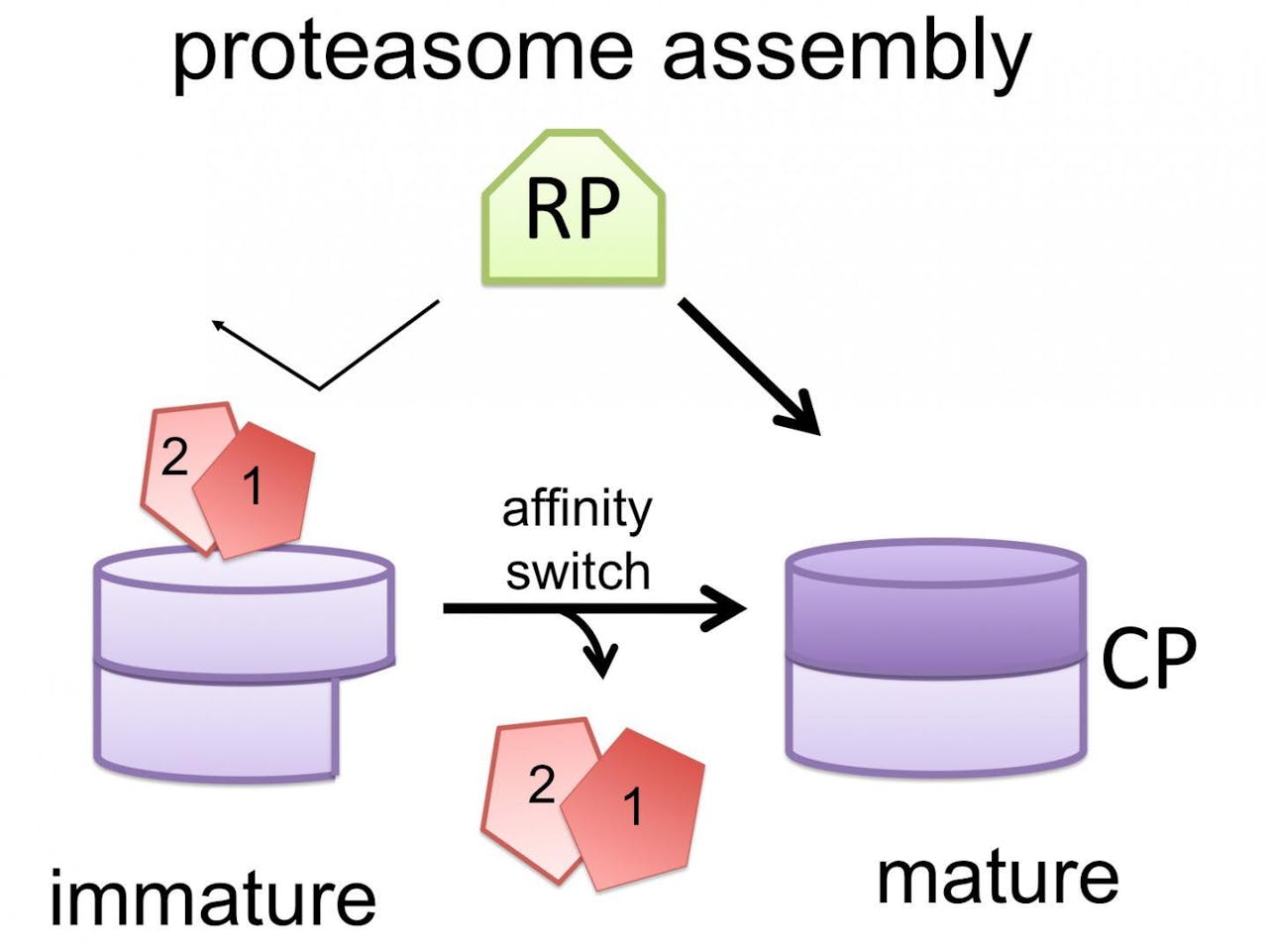
De grotere onderdelen hebben verschillende taken. Er wordt een regeldeeltje in elkaar gezet dat de gemarkeerde eiwitten herkent en oppikt. Daarnaast is er een kerndeeltje dat het knippen van eiwitten in kleinere stukjes voor zijn rekening neemt.
Roelofs en zijn collega’s laten nu zien hoe belangrijk de helpereiwitten zijn om de stapeling van het regel- en kerndeeltje tot proteasoom goed te laten verlopen. Soms is het kerndeeltje nog niet af, maar probeert het regeldeeltje er toch al aan vast te klitten. Dat is niet de bedoeling: bij het maken van een kast moeten de afzonderlijke lades ook eerst af zijn voor je ze goed kunt stapelen.
Uit de experimenten blijkt dat een nog onafgemaakt kerndeeltje helpereiwitten aan zich bindt. Hij gebruikt ze als schild om het regeldeeltje van zich af te houden. Maar zodra het kerndeeltje helemaal gevormd is, zet het een moleculaire schakelaar om, waarop het de helpereiwitten loslaat, ontdekten de biologen. Als de schakelaar om is kan het regeldeeltje binden aan het kerndeeltje om een proteasoom te vormen.
Alzheimer
Met wiskundige modellen toonde Roelofs aan dat de assemblage van het proteasoom zonder deze moleculaire schakelaar minder efficiënt gaat. De schakelaar voorkomt dat onderdelen vast komen te zitten in een positie die een misvormde machine oplevert. Roelofs: “Er is maar één goede mogelijkheid waarop alle onderdelen in elkaar passen. De helpereiwitten zorgen ervoor dat het proces in de juiste volgorde gebeurt.”
Het onderzoek levert vooral veel fundamentele kennis op over hoe de cel zijn ingewikkelde machinerie bouwt. Naast proteasomen assembleren onder andere ook ribosomen, de eiwitfabriekjes van de cel, zichzelf met behulp van gereedschappen.
Het team blikt ook vooruit op hoe deze kennis de menselijke gezondheid kan verbeteren. “We weten dat in veel neurodegeneratieve ziektes zoals Alzheimer bepaalde eiwitten ophopen. Proteasomen draagt hieraan bij wanneer ze minder actief worden en dus minder eiwit afbreken”, aldus Roelofs. “Het regelen van de hoeveelheid proteasomen kan medisch voordeel hebben. Dit onderzoek geeft ons inzicht in waar in het proces we de vorming van proteasomen kunnen aanpassen.”

