Het is me gelukt! Ik heb bijgedragen aan de wetenschap! Twee door mij ontwikkelde methoden om eiwitten aan te passen onder bacterie-vriendelijke condities zijn namelijk gepubliceerd. Hoera!
Vier jaar werk zijn opgesomd in enkele A4’tjes tekst met wat plaatjes. Door mij geschreven en gemaakt! Je legt er precies in uit wat er is onderzocht en waarom. De rest van zo’n artikel bestaat uit een heleboel metingen en bewijsmateriaal om andere wetenschappers te laten zien dat de methode daadwerkelijk werkt. Hiermee zijn mijn methoden nu dus algemene kennis geworden. Want iedereen ter wereld kan de artikelen downloaden, lezen en gebruiken. Jij ook!

Ik heb bijgedragen aan de wetenschap!
Pixabay CC0Te gek, he? Alleen is het misschien wel lastig leesbaar voor iemand die geen scheikunde heeft gestudeerd. Dus ik probeer om ook voor niet-chemici de kennis algemeen beschikbaar te maken.
Voor wie mijn onderzoek enigszins gevolgd heeft, weet dat ik probeer om een samenwerking aan te gaan met bacteriën om samen nieuwe antibiotica te maken. Bacteriën zijn namelijk eigenlijk hartstikke goed in scheikunde en ze kunnen schitterende moleculen maken. En het klinkt misschien wat tegenstrijdig, maar bacteriën maken ook antibiotica. Om zichzelf tegen andere bacteriën te beschermen. Deze antibiotica zijn behoorlijk ingewikkelde moleculen. Zelfs zo ingewikkeld dat het een chemicus maanden kost om er een paar milligram van in het lab te maken.
Een bacterie draait er z’n hand niet voor om en maakt zo een paar honderd milligram in één nacht. Het nadeel van bacteriën is alleen dat ze heel moeilijk variaties van hetzelfde molecuul kunnen maken. Ze kunnen dus maar één soort antibiotica maken. Maar we hebben juist variaties van zo’n molecuul nodig om het te kunnen gebruiken als medicijn voor mensen. Chemici kunnen nu juist wel heel goed variaties aanbrengen aan moleculen! Dat komt omdat wij van een ander soort ‘chemisch’ gereedschap gebruik maken dan bacteriën: wij zijn in staat om metaalkatalysatoren te gebruiken.
Nu heb ik dus geprobeerd om de chemische kwaliteiten van de bacteriën te combineren met de kwaliteiten van een chemicus op het lab. Ik laat de bacteriën eerst dat super-ingewikkelde antibiotica-molecuul maken en vervolgens probeer ik dat molecuul aan te passen met mijn metaalkatalysatoren om een aantal eigenschappen, zoals de oplosbaarheid of stabiliteit, net even wat te verbeteren. Mijn aanpassing moet natuurlijk wel heel specifiek zijn. Het heeft geen zin als ik het molecuul op allerlei verschillende plekken verander, want dan verandert het misschien teveel en werkt het helemaal niet meer als antibioticum. Ik heb daarom gezocht naar een manier om heel specifiek één aminozuur te veranderen en de andere aminozuren ongemoeid te laten.
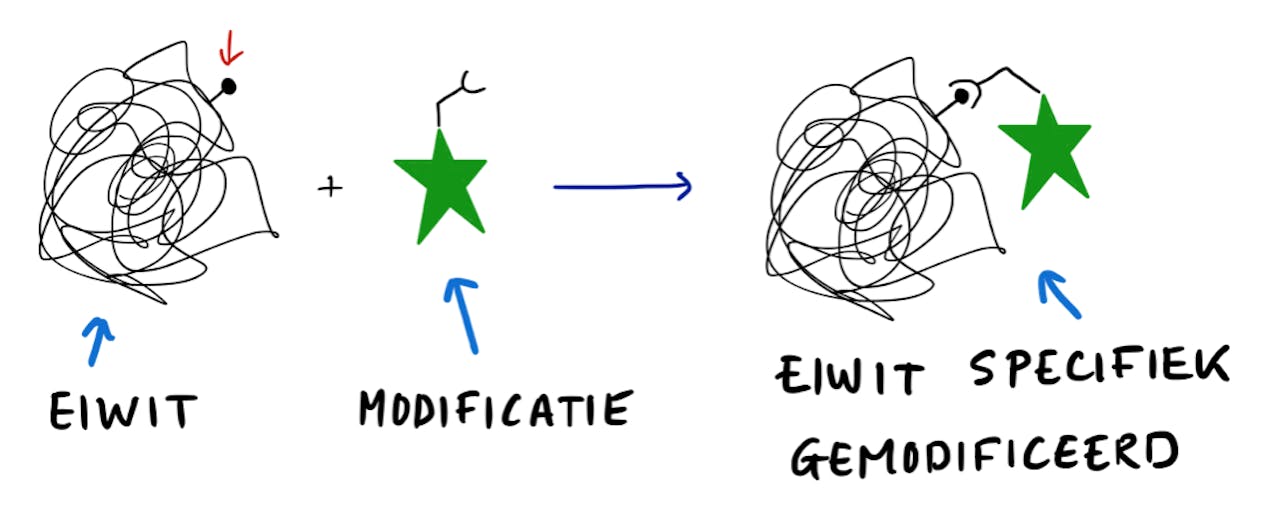
De artikelen die ik nu over mijn onderzoek geschreven heb, zijn daarom gefocust op en één speciaal aminozuur: dehydroalanine. Dit is een bijzonder aminozuur, want het is niet één van de twintig gangbare aminozuren die je in eiwitten tegenkomt. Het bijzondere van dehydroalanine is dat het een dubbele koolstof-koolstof binding bevat. Deze dubbele binding kan andere chemie ondergaan dan de andere aminozuren in een eiwit. Je brengt daarmee dus veranderingen aan, omdat je andere chemie kan doen in vergelijking met de ‘normale’ aminozuren, maar de dubbele binding zorgt ook voor specificiteit. Als alleen de dubbele binding reageert, blijft de rest van het eiwit onveranderd.
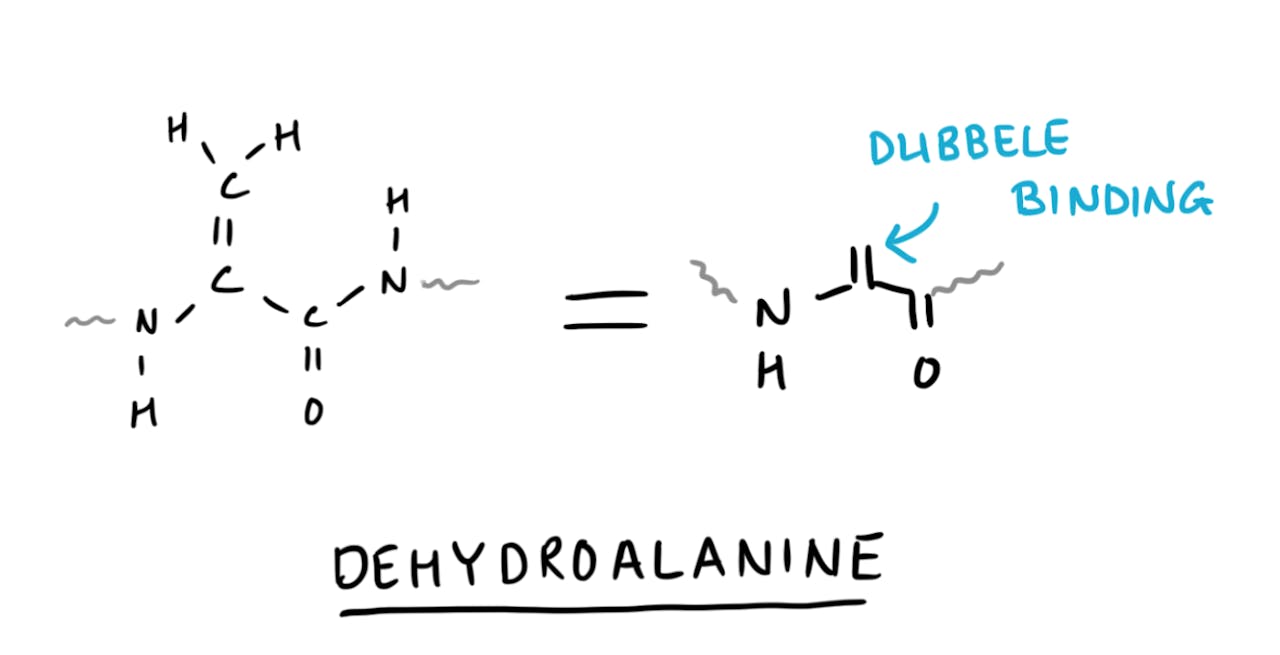
Dehydroalanine
Dowine de Bruijn voor NEMO KennislinkPalladium
In het eerste artikel gebruik ik palladium om met de dubbele binding te reageren en zo een koppelingsreactie plaats te laten vinden. Een koppelingsreactie is een reactie waarbij een nieuwe koolstof-koolstof binding wordt gevormd tussen twee losse moleculen. In dit geval koppel ik verschillende benzeenringen aan het aminozuur dehydroalanine. Het palladium heeft in dit geval twee taken: het activeren van de benzeenring en het leiden ervan naar de dubbele binding van dehydroalanine. Je kunt de reactie in een paar stappen uittekenen:
- Stap 1: Het palladium gaat op de benzeenring zitten en activeert hiermee de ring
- Stap 2: Het palladium ‘zoekt’ vervolgens de dubbele binding en brengt de benzeenring erheen
- Stap 3: De benzeenring koppelt aan de dehydroalanine, het palladium schuift een stapje op
- Stap 4: De dubbele binding wordt weer hersteld en palladium verlaat het molecuul
Het resultaat is een nieuwe binding tussen het aminozuur dehydroalanine en de benzeenring. En het palladium gebruik je weer om nog een keer zo’n koppeling uit te voeren. Dat is ook precies de definitie van een katalysator: hij helpt bij de reactie, want zonder palladium gebeurt er niets, maar een katalysator wordt niet opgebruikt. Je wint hem aan het einde van de reactie weer terug.
Het was al veel langer bekend dat palladium zulke koppelingsreacties kan doen (is zelfs een Nobelprijs aan toegekend in 2010), maar het was nog nooit geprobeerd onder bacterie-vriendelijke condities en op dehydroalanine in een groot eiwit. Ik heb als eerste ter wereld beschreven dat dit kan en hoe dit moet. Nu hopen dat andere wetenschappers deze nieuwe uitvinding ook gaan gebruiken. Het zou toch fantastisch zijn als er meer medicijnen gemaakt kunnen worden met deze nieuwe techniek?
Iridium
Het tweede artikel gaat over iridium. Een ander metaal waar bacteriën eigenlijk nooit gebruik van maken. Mensen gebruiken het trouwens ook niet zo heel veel, want het is behoorlijk duur (duurder dan goud!). De laatste tijd is het wel een trend onder chemici om meer met iridium te doen, omdat er is ontdekt dat je iridiumkatalysatoren kan ‘aanzetten’ door er met licht op te schijnen. De katalysator is dan in een aangeslagen toestand en kan dan een ander molecuul activeren. Licht is natuurlijk een fantastische energiebron. Het is goedkoop, want je hoeft alleen maar overdag naar buiten te gaan en je hebt het al gratis. Bovendien is zichtbaar licht (dus niet UV!) niet giftig en het geeft ook geen afval. Allemaal gunstige eigenschappen. Zeker als je denkt aan duurzaamheid.
Met het licht breng je dus eerst je katalysator in de aangeslagen toestand. (stap 1). In deze toestand kan een molecuul heel gemakkelijk een elektron opnemen of afstaan, het wordt een betere reductor of oxidator (zie blog fiets). In mijn geval, neemt de katalysator een elektron op van een ander molecuul. Hierdoor maakt de iridiumkatalysator van dit tweede molecuul een radicaal (stap 2). Een radicaal is eigenlijk een heel erg geactiveerd molecuul dat heel graag en heel snel weer verder wil reageren. Het radicaal zal dan ook ontzettend snel koppelen met de dubbele binding in dehydroalanine. Hierdoor ontstaat een weer een nieuwe koolstof-koolstof binding (stap 3). In de laatste stap geeft de iridium katalysator het elektron weer terug. Zo win je de iridium katalysator aan het einde van deze reactie ook weer terug.
Licht gekatalyseerde redoxchemie (of photoredox catalysis), is heel erg ‘in’ op dit moment. Je kan wel zeggen dat het een beetje een hype is, een trend binnen de scheikunde. Daar kan je als wetenschapper natuurlijk slim gebruik van maken. Als iets in is, zijn er meer mensen in geïnteresseerd. Ik hoop dus dat veel mensen het artikel lezen en gebruiken.
Hiermee heb ik de eerste stap naar nieuwe medicijnen gezet. De methoden zijn beschreven en gedeeld met de hele wereld. Nu is het aan een andere wetenschapper om de methode te gebruiken en te testen of de nieuwe moleculen die je met deze nieuwe methoden kan maken, ook betere antibiotica zijn. Er is dus nog wel een lange weg te gaan voordat het in de apotheek verkrijgbaar is.

