Verouderde cellen doen in een lichaam vaak meer kwaad dan goed. Patholoog Roel Goldschmeding ontdekte een manier om verouderde cellen uit de nieren te verwijderen, maar daar zitten nog wel wat haken en ogen aan.
Bij patiënten met een erfelijke stoornis in het FAN1-gen gaat de nierfunctie versneld achteruit. FAN1 is essentieel voor de reparatie van beschadigd DNA. In de nieren van patiënten worden vaak veel verouderde cellen gezien. Er is blijkbaar een verband tussen DNA-schadeherstel en veroudering. Dit verband zette Roel Goldschmeding, patholoog aan het UMC Utrecht, op het spoor van het verwijderen van verouderde cellen.
Geprogrammeerde celdood
“Verouderde cellen zijn cellen die schade hebben opgelopen en zich niet meer herstellen”, vertelt Goldschmeding. “Normaal gesproken zouden dit soort cellen spontaan dood moeten gaan, maar dat doen ze niet altijd. Sommige cellen blijven zitten en proberen zichzelf steeds opnieuw te repareren, zonder succes. Dit geeft twee problemen. Ten eerste ontstaat er plaatsgebrek. Verouderde cellen voeren hun eigen functie niet meer uit, maar kunnen ook niet vervangen worden door gezonde cellen. Ten tweede hebben verouderde cellen een negatief effect op gezonde cellen in hun omgeving.”
Waarom niet alle cellen met een beschadiging direct doodgaan, is wel te verklaren. Cellen die zichzelf niet meer kunnen herstellen, verdwijnen als het goed is vanzelf door geprogrammeerde celdood (apoptose). Deze cellen worden van binnenuit opgeruimd, zonder dat de omgeving daar last van heeft. Maar om te voorkomen dat iedere cel bij een minimale beschadiging gelijk in apoptose gaat, bevat iedere cel ook machinerie om geprogrammeerde dood te voorkomen. Die machinerie is bij verouderde cellen die te lang blijven zitten heel actief.
Een donornier gaat nooit zo lang mee als een gezonde eigen nier. Dat komt doordat cellen na een niertransplantatie veel prikkels krijgen en daardoor versneld verouderen.
Flickr.com, North Dakota National Guard via CC BY-NC-SA 2.0Vicieuze cirkel
Versnelde veroudering van cellen komt vaak voor na een niertransplantatie. Goldschmeding: “De meeste donornieren gaan tien tot vijftien jaar mee. Soms houden ze het twintig jaar vol, maar nooit zo lang als een gezonde nier. Uit biopten van patiënten blijkt dat er vaak veel verouderde, beschadigde cellen aanwezig zijn in een getransplanteerde nier.” Cellen in een donornier ontvangen veel prikkels. Ze komen van een relatief gezonde omgeving terecht in een ongezond milieu. Er komt wellicht een afweerreactie op gang en daar worden dan medicijnen voor gegeven, die ook bijwerkingen kunnen hebben.
Door al die prikkels belandt de cel in een soort stress-situatie. Gestreste cellen roepen het afweersysteem om hulp en dat leidt tot de productie van verschillende signaalstoffen die ontsteking en verlittekening bevorderen. Als de cellen niet doodgaan, maar in hun gestreste toestand blijven hangen, verspreiden de signaalstoffen zich in hun omgeving. Daardoor raken ook gezonde omliggende cellen beschadigd. Ook die cellen gaan op hun beurt om hulp roepen. En zo ontstaat er een vicieuze cirkel waarbij steeds meer cellen beschadigd raken, omdat hun gestreste buren niet in apoptose gaan.
Medicijn voor kanker
Volgens Goldschmeding is de te actieve machinerie om geprogrammeerde celdood te voorkomen de achilleshiel van verouderde cellen. Als je erin slaagt om die machinerie te blokkeren, gaan de cellen gewoon in apoptose en doorbreek je de vicieuze stresscirkel. “De eerste methode die hiervoor getest is, is een genetische truc. Bij proefdieren slaagden Amerikaanse onderzoekers erin het DNA van cellen zo aan te passen dat de zelfmoordmachinerie werd ingeschakeld. Er waren minder verouderde cellen aanwezig in het nierweefsel en de proefdieren bleven langer gezond.” Helaas is een genetische aanpassing geen methode die makkelijk toe te passen is bij patiënten.
Daarom doet Goldschmeding onderzoek naar de bruikbaarheid van senolytica, medicijnen die oorspronkelijk ontwikkeld zijn voor de behandeling van kanker. Want net als verouderde niercellen, hebben kankercellen het probleem dat ze, ondanks hun afwijkende DNA, niet in apoptose gaan. Senolytica zorgen ervoor dat het tumoronderdrukkende eiwit p53 de verouderde cellen alsnog in apoptose laat gaan. Het probleem met deze medicijnen is dat ze op dit moment nog niet specifiek genoeg werken. Niet alleen kankercellen, maar ook sommige gezonde cellen worden tot zelfmoord aangezet en dat geeft nare bijwerkingen.
Profiel van cellen
Goldschmeding hoopt dat het mogelijk is om de bestaande medicijnen zo aan te passen dat ze bijvoorbeeld specifiek verouderde cellen van de nierbuisjes aanvallen. “Binnen het onderzoeksconsortium TASKFORCE zijn we op zoek naar het beste doelwit voor deze medicijnen”, vertelt hij. “Dat doen we door de profielen van de cellen van verschillende patiënten met elkaar te vergelijken. Bij sommige patiënten is de ziekte stabiel, bij andere gaat de nierfunctie juist snel achteruit. Welke verschillen zie je in de cellen van deze groepen patiënten?”
Omdat het effect van verouderde cellen op hun omgeving een belangrijke rol speelt, heeft het geen zin om alleen naar losse cellen te kijken. De onderzoekers bestuderen daarom ook waar de belangrijke cellen zich in het weefsel bevinden en hoe hun omgeving eruit ziet. Zit een verouderde cel in een omgeving met veel ontsteking en verlittekening, dan is het waarschijnlijk relevanter om hem weg te halen dan als zo’n cel omringd wordt door gezonde cellen.
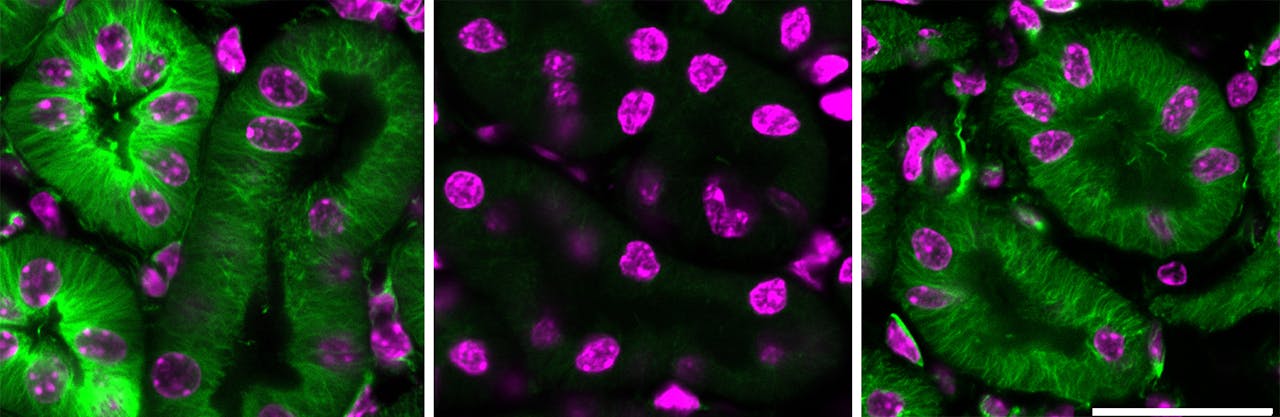
Niercellen van muizen, gezien door een microscoop. Door alleen naar cellen te kijken is niet te bepalen of ze verouderd zijn of niet.
Flickr.com, NIH Image Gallery, publiek domeinBiomarker in urine
Als het lukt om een medicijn te maken dat specifiek verouderde cellen uit de nier kan verwijderen, is er nog een praktisch probleem. Want hoe weet je wanneer het tijd is om de cellen te verwijderen en hoe voorkom je dat je met een behandeling zoveel cellen verwijdert dat er niks overblijft? “Als er al heel veel verouderde cellen zijn, ben je te laat. Dan blijft er na behandeling een bijna acellulaire nier over”, zegt Goldschmeding. “Op dit moment is het alleen mogelijk om verouderde cellen aan te tonen in een nierbiopt. Nierbiopten kun je niet onbeperkt afnemen. Dat is erg belastend voor de patiënt en kan schadelijk zijn voor gezond nierweefsel. Wij onderzoeken daarom ook of het mogelijk is om verouderde niercellen of producten daarvan aan te tonen in urine.”

Kunnen verouderde cellen, of producten daarvan, via urine worden opgespoord?
Wikimedia Commons, Daniz 01 via CC BY-SA 4.0Niercellen scheiden exosomen af. Dit zijn een soort blaasjes die belangrijk zijn voor de communicatie tussen cellen onderling. Oude, zieke cellen scheiden andere blaasjes af dan gezonde cellen. “We hopen dat we hier een biomarker uit kunnen halen die aantoonbaar is in urine, zodat we straks aan de hand van een urinemonster kunnen bepalen of er verouderde cellen verwijderd moeten worden of niet.”
Een kant en klare aanpak voor het verwijderen van verouderde cellen is er dus nog niet. Maar mocht die er in de toekomst komen, dan blijft de toepassing ervan waarschijnlijk niet beperkt tot nierziekten. Er zijn een heleboel ziekten waarbij verouderde, beschadigde cellen een rol spelen. Neem bijvoorbeeld kanker, maar ook een ziekte als longfibrose, waarbij verouderde cellen verlittekening van het longweefsel veroorzaken. De longen kunnen daardoor uiteindelijk onvoldoende zuurstof opnemen. Ook de patiënten die aan deze ziektes lijden, zouden met het verwijderen van verouderde cellen geholpen kunnen zijn.