Voor mensen met diabetes type 1 is er nog altijd geen geneesmiddel. Transplantatie van de alvleesklier is een mogelijkheid, maar dat is een ingrijpende operatie en het tekort aan donoren is schrijnend. Vandaar dat onderzoekers een oplossing op kleine schaal proberen te vinden: transplanteer alleen de insulineproducerende cellen. Die zijn óók schaars, maar – zo redeneren Leidse onderzoekers – die kun je dan opkweken.
Bij een type 1 diabetespatiënt zijn de bètacellen, die verantwoordelijk zijn voor de insulineproductie, defect of vernietigd. Om toch hun bloedsuikerspiegel op peil te houden spuiten mensen met type 1 diabetes insuline. Maar dat is symptoombestrijding: voor het onderliggende probleem is er geen oplossing. Zijn bètacellen eenmaal kapot, dan kunnen ze niet worden gerepareerd.

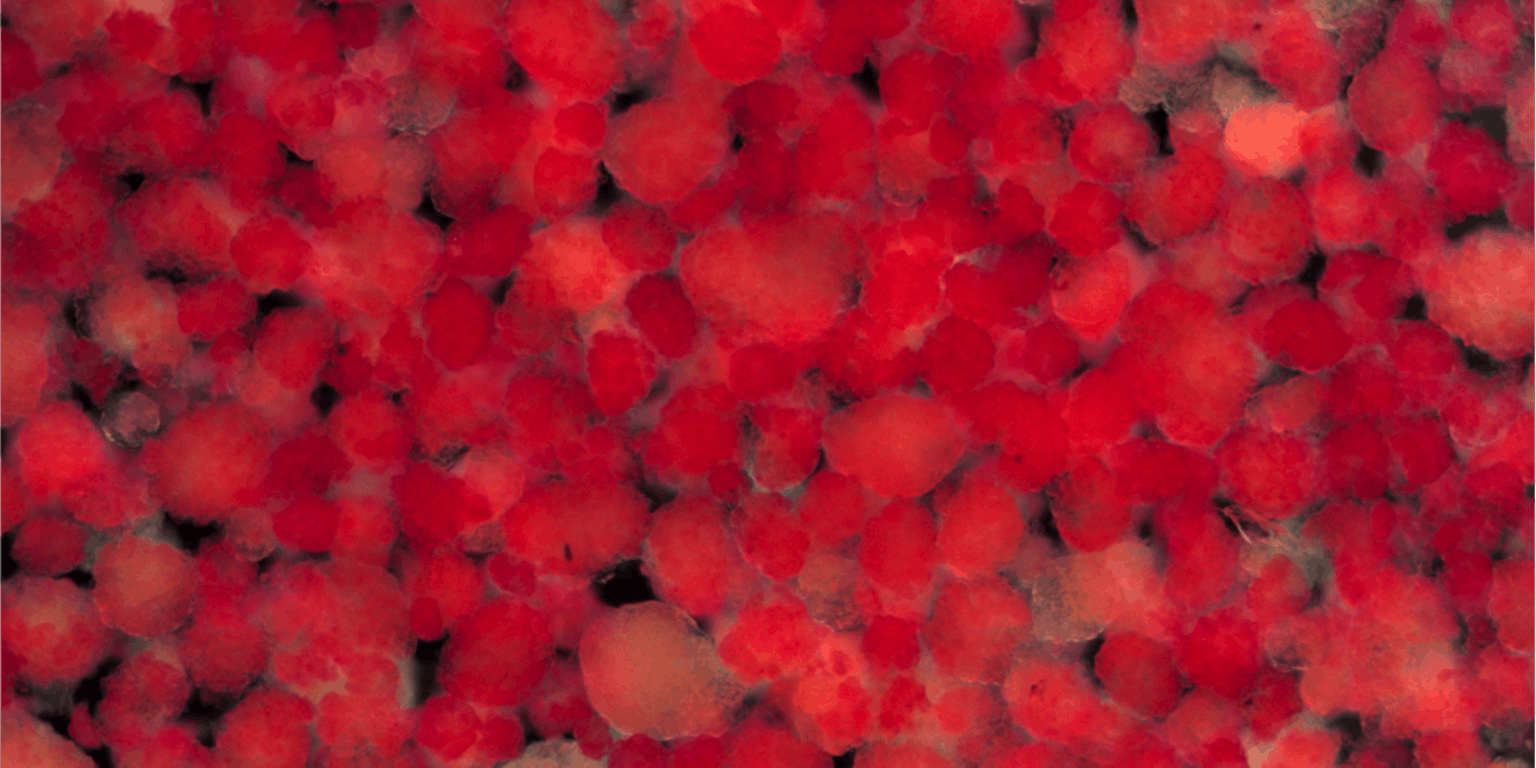
Eilandjes van Langerhans (in rood) kunnen uit de alvleesklier worden geïsoleerd en gescheiden van het overige weefsel. De diameter van een eilandje is ongeveer een tiende millimeter.
Françoise CarlottiVervangen kan wel. Een patiënt kan een donoralvleesklier krijgen, inclusief eilandjes van Langerhans met daarin werkende bètacellen. Probleem is alleen: zo’n transplantatie is een heftige ingreep en er zijn erg weinig donoren. Per jaar komen er ongeveer 250 donoralvleesklieren beschikbaar – te weinig voor de honderdvijftigduizend Nederlanders met diabetes type 1. Bovendien wordt het orgaan na transplantatie soms alsnog afgestoten.
Sinds 2008 worden de eilandjes ook los getransplanteerd. Ze worden ingespoten in de poortader van de lever. Het donortekort blijft echter een probleem, en een patiënt moet medicijnen blijven slikken tegen afstotingsverschijnselen.
Bètacellen kweken
De Leidse onderzoekster Françoise Carlotti en haar collega’s zoeken dan ook naar een manier om insulineproducerende cellen te maken, zonder afhankelijk te zijn van donoren. Het doel: gekweekte eilandjes van Langerhans, met bètacellen, helemaal klaar voor transplantatie.
Verschillende opties zijn denkbaar om dat doel te bereiken, vertelt Carlotti, assistant professor bij de Diabetesgroep van de afdeling Nierziekten van het Leids Universitair Medisch Centrum (LUMC). Het makkelijkst zou zijn om bètacellen bij een gezonde donor weg te nemen, te vermenigvuldigen in het lab en dan te implanteren bij de patiënt met diabetes type 1. Promovenda Maaike Roefs, eveneens van het LUMC, houdt zich bezig met die mogelijkheid.
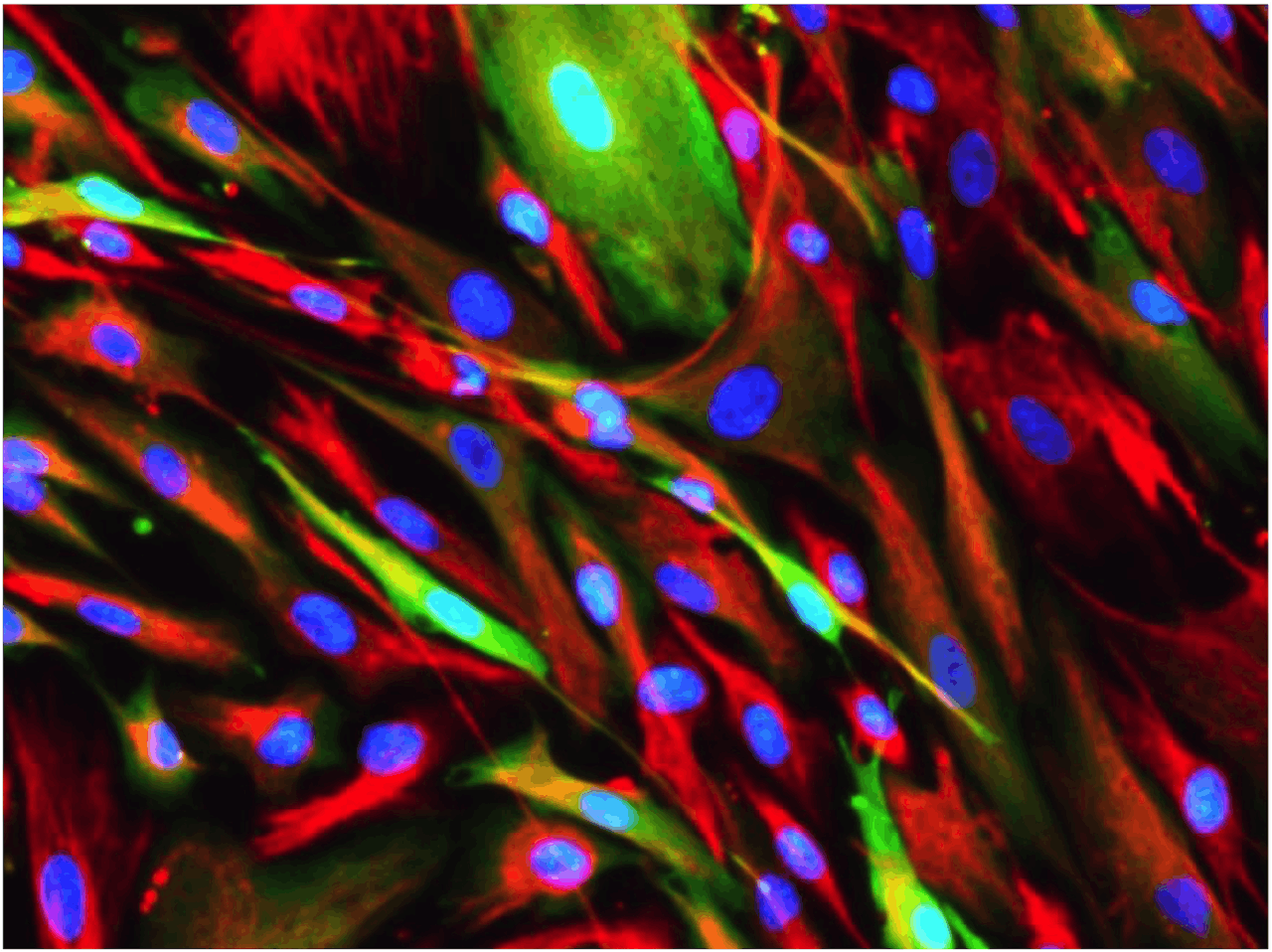
Beta-cellen (in groen) kunnen worden gekweekt in een kweekplaat, waarbij ze veranderen van identiteit. Een kenmerk van deze ‘nieuwe’ identiteit is aangekleurd in rood. Celkernen zijn blauw aangekleurd.
Françoise CarlottiDe precieze trigger
Bètacellen kweken klinkt eenvoudiger dan het is. Ze willen zich namelijk noch in het lichaam, noch in een schaaltje in het laboratorium vermenigvuldigen. Bovendien veranderen de cellen die je probeert te kweken van identiteit. Ze starten als insulineproducerende bètacellen, maar transformeren spontaan in een ander type cel die geen insuline meer produceert.
“Het voordeel daarvan is dat we die cellen wel kunnen vermeerderen”, zegt Roefs. Ze werkt daarvoor samen met biotechnologiebedrijf Xpand). “Maar nu moeten we nog een manier zien te vinden om ze weer te veranderen in bètacellen.” De gedachte is dat de gekweekte cellen geschikt zijn voor insulineproductie, omdat de cellen dat van oorsprong konden.
Het onderzoek naar die weg terug is gaande. Door de cellen zich te laten groeperen en verschillende groeifactoren toe te voegen, lukt het al om ze een klein beetje terug te laten keren naar hun oorspronkelijke functie. Naar de precieze trigger om de cellen weer in vorm te krijgen voor insulineproductie is het nog zoeken.
Zoeken naar de doorbraak
Roefs werkt daarvoor samen met het biotechnologiebedrijf Galapagos, dat op grote schaal de werking van verschillende medicijnen op weefsel test. Handig: zo kan in korte tijd de werking van stoffen als groeifactoren getest worden op de gekweekte bètacellen, een grote stap in de zoektocht naar de factoren die de cellen terug kunnen laten keren naar hun bèta-oorsprong.
Als dat lukt, zou dat de doorbraak zijn waar Roefs op hoopt. De cellen zouden in een soort mal kunnen worden geplaatst en een diabetespatiënt kan dan nieuw gekweekte eilandjes van Langerhans krijgen, zonder tekort aan donormateriaal.
Andere kandidaten
Van de 250 donoralvleesklieren die er jaarlijks in Nederland beschikbaar zijn, worden sommige alleen gebruikt om de eilandjes van Langerhans – zo’n een procent van het totale orgaan – te transplanteren. De rest van de alvleesklier is dan vaak waardeloos geworden. Zonde, vinden de onderzoekers. Dat resterende materiaal zou nog wel eens van pas kunnen komen.
Een van de hoofdonderdelen van de alvleesklier is het uitgebreide gangenstelsel, dat alle verteringssappen verzamelt en richting de darmen leidt. Die gangen worden gevormd door zogenoemde ductcellen. En die ductcellen zijn belangrijk in de vorming van bètacellen: tijdens de ontwikkeling van de alvleesklier – in de baarmoeder – ontstaan de eilandjes van Langerhans vanuit embryonale ductcellen. “Die embryonale ontwikkeling kunnen we mogelijk in een kweekschaaltje nabootsen”, zegt Tim Dielen, die bij de Diabetesgroep aan dit project samenwerkt met promovendus Jeetindra Balak.
Embryonale ontwikkeling
De uitdaging: volwassen ductcellen ertoe zien te bewegen dat ze zich gaan gedragen als embryonale ductcellen, zodat ze zich vervolgens kunnen specialiseren richting bètacel. Dielen: “Het is puzzelen. Je moet het hele proces van de ontwikkeling van bètacellen in kaart brengen. Die informatie kunnen we dan gebruiken om de cel de goede richting op te sturen.”
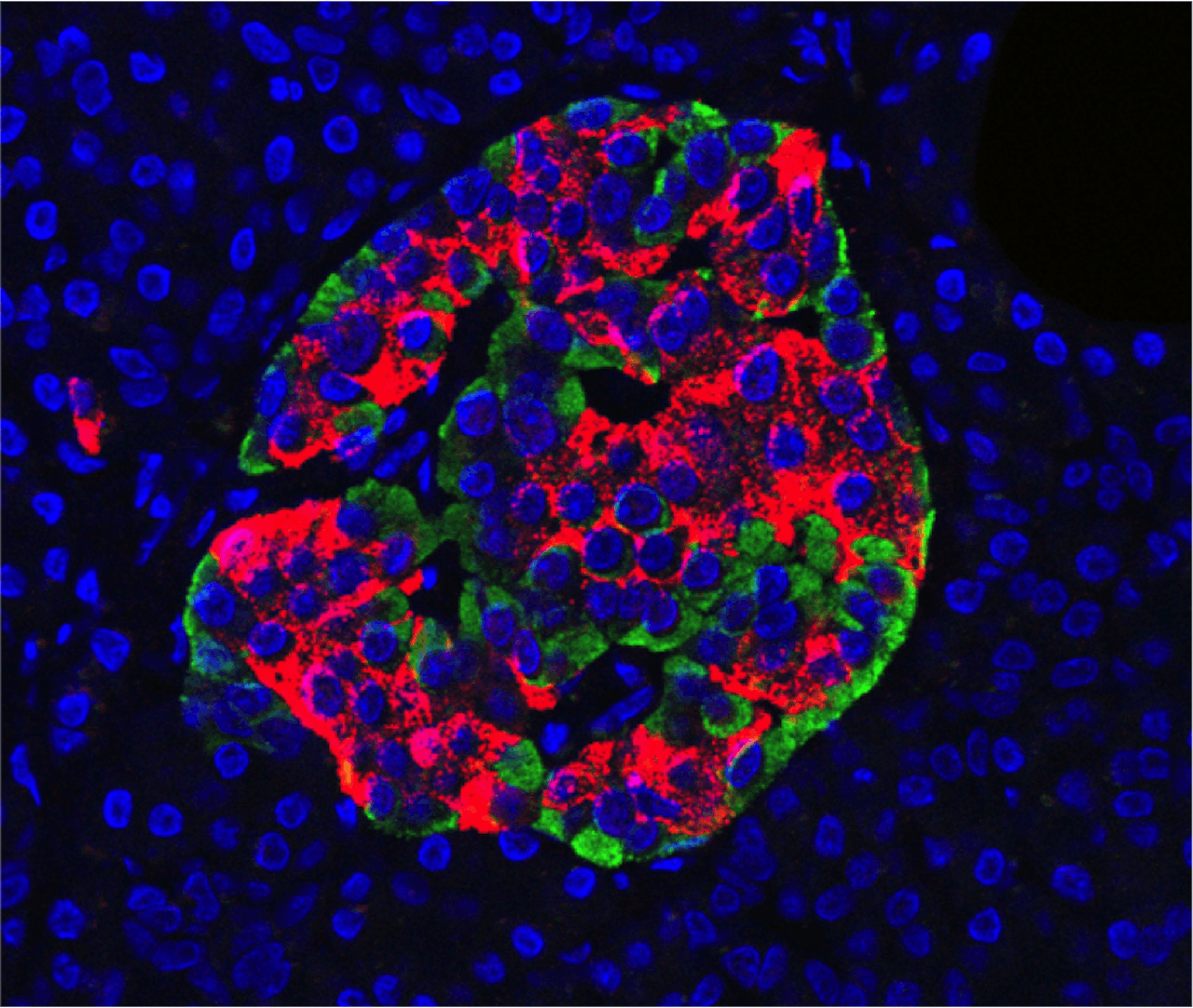
Een eilandje van Langerhans onder de microscoop. Celkernen zijn blauw, insuline-producerende cellen (bèta-cellen) rood en glucagon-producerende cellen (alpha-cellen) groen.
Françoise CarlottiDe onderzoekers experimenteren met verschillende groeifactoren. Het is nu mogelijk ductcellen te kweken in een speciaal soort gel, waarbij de cellen uit zichzelf gangen lijken te vormen zoals in de embryonale pancreas. De volgende stap is de ontwikkeling van deze cellen naar bètacellen. De onderzoekers slaagden er al in om een proof of concept te laten zien: een klein percentage van de gekweekte ductcellen produceert inmiddels insuline.
Een derde mogelijkheid om insuline producerende cellen te kweken, is werken vanuit alfacellen die ook in de eilandjes van Langerhans te vinden zijn en de tegenhanger van insuline produceren: glucagon. De onderzoeksgroep van het LUMC ontdekte dat bètacellen soms spontaan veranderen in alfacellen. Als we die spontane verwisseling kunnen omkeren, is de gedachte, dan biedt dat perspectief voor een alternatieve bron voor insulineproducerende cellen.
Strengere regels
Carlotti en collega’s focussen zich in hun onderzoek enkel op menselijke cellen. Daar kleven nadelen aan: het beperkt de snelheid van het onderzoek. Niet alleen vanwege de strengere regels, maar ook omdat er zo weinig materiaal is om mee te werken. Van de donororganen kunnen ongeveer tachtig alvleesklieren per jaar worden gebruikt voor onderzoek, mits daarvoor toestemming is gegeven door de nabestaanden.
Maar voor vertaling naar klinische toepassingen zijn humane cellen cruciaal. “Veel onderzoeksgroepen die met dierlijke cellen werken publiceren prachtige resultaten, maar vaak zeggen zulke resultaten weinig over hoe het bij mensen werkt”, zegt Carlotti.