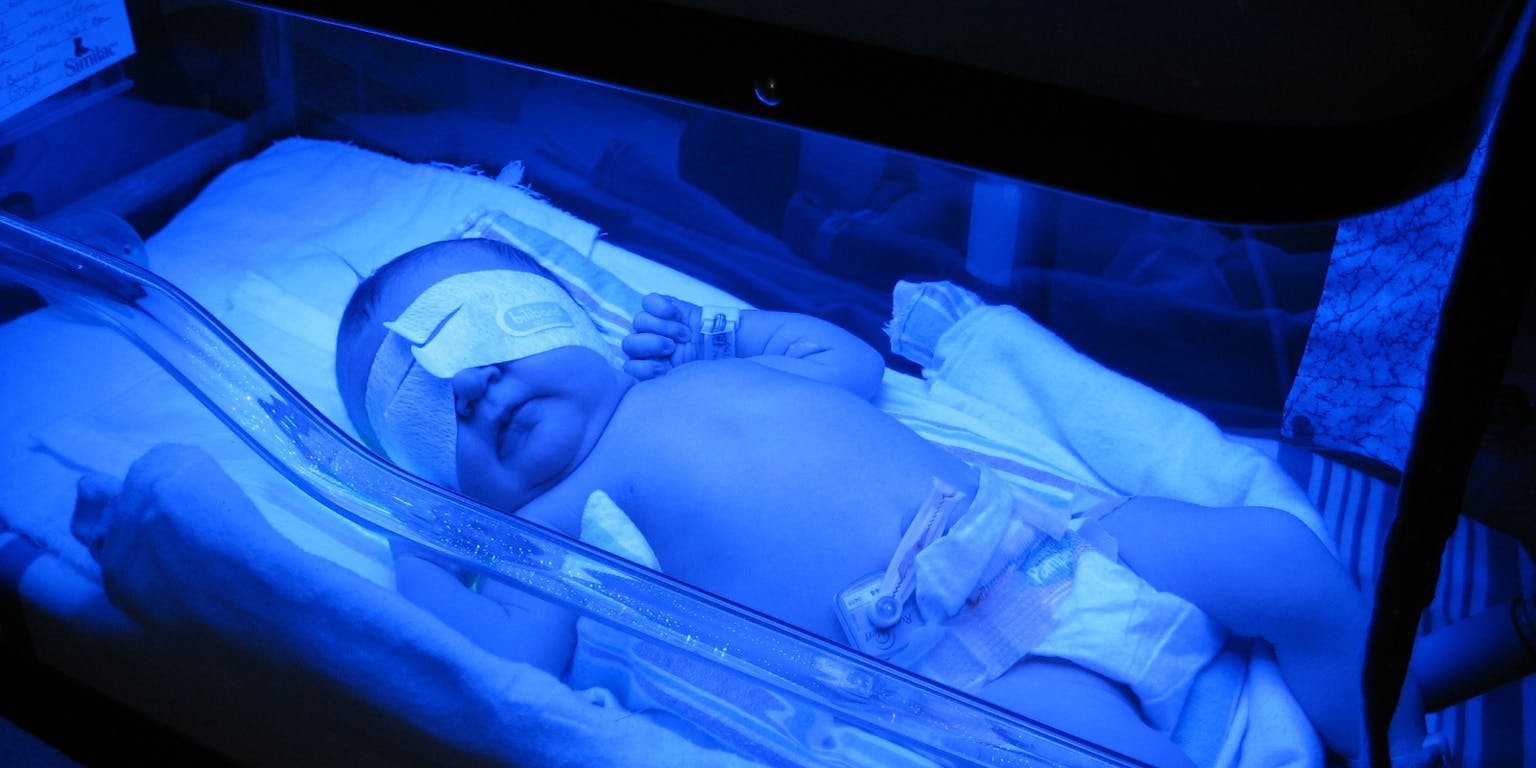
Tien uur per dag aan bed gekluisterd onder een felblauwe lamp, je hele leven lang. Dit is voor enkele mensen in Nederland van levensbelang. Voor één van hen is het binnenkort wellicht verleden tijd. In het AMC start de eerste patiënt met een nieuwe gentherapie voor erfelijke geelzucht.
Er zijn jaren overheen gegaan, maar nu is er eindelijk groen licht om de gentherapie bij deze ziekte te testen. De eerste Nederlandse patiënt kreeg in januari de injectie met het nieuwe gen. Piter Bosma, moleculair bioloog bij het AMC in Amsterdam, is al zo’n dertig jaar bezig om de oorzaak van geelzucht te achterhalen. “Dat begon in de jaren 90; het gen dat geelzucht veroorzaakt was destijds nog niet eens bekend. Dat hebben we eerst opgespoord. Toen de genetische veroorzaker bekend was konden we gaan werken aan een oplossing.” Gentherapie bleek hiervoor een goede kandidaat.
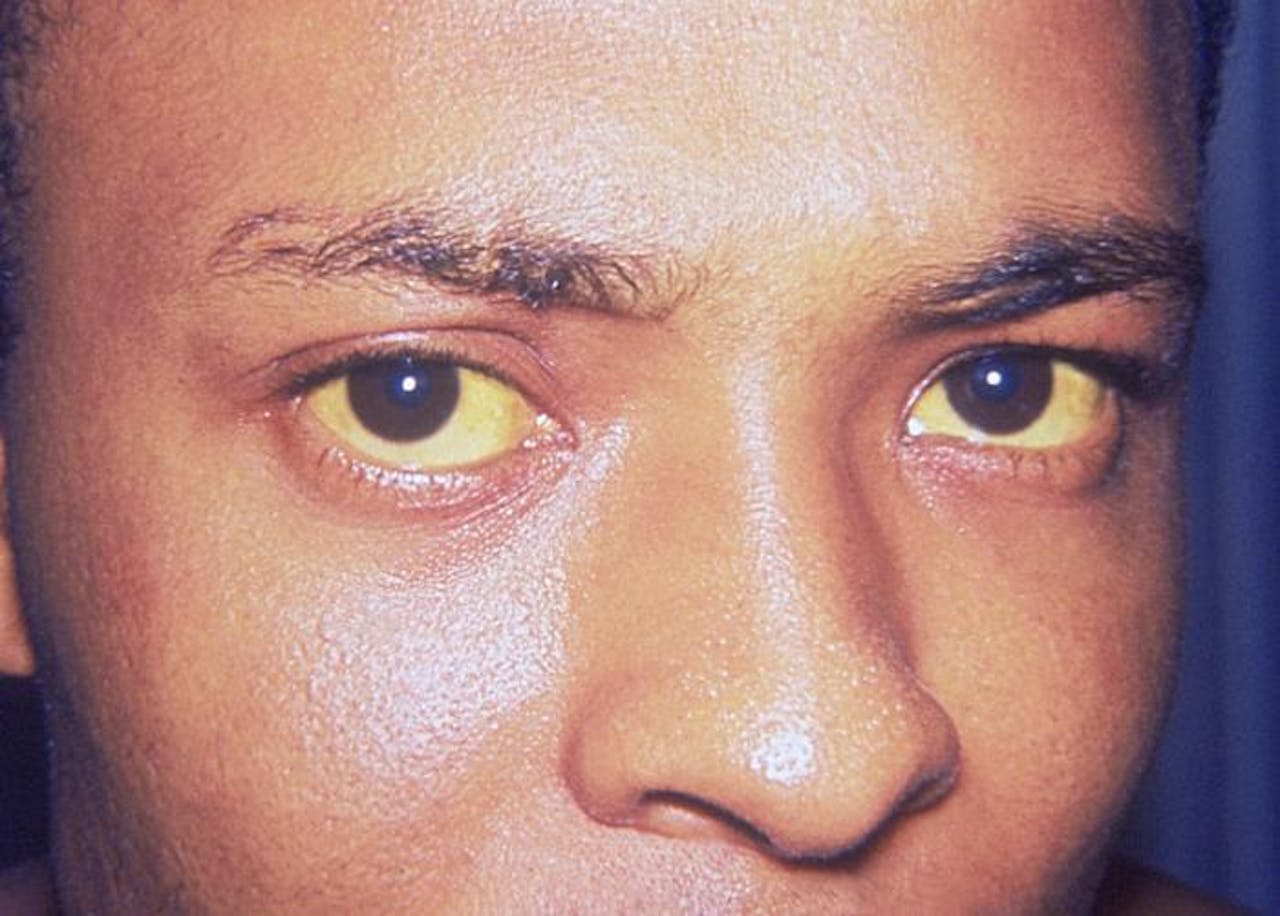
Leverproblemen kunnen leiden tot geelzucht. De gele kleur is vooral in de ogen te zien en wordt veroorzaakt door een restproduct van rode bloedcellen, bilirubine. Op den duur kan dat hersenschade geven.
CDC/Dr. Thomas F. Sellers/Emory UniversityGeelzucht dankt zijn naam aan de verkleuring van de huid, die ontstaat wanneer de lever hemoglobine, een stofje in de rode bloedcellen dat zuurstof door ons lichaam vervoert, niet volledig afbreekt. Bilirubine blijft dan achter en dat geeft de gele kleur. De oorzaak van geelzucht zit niet altijd in de genen. Het komt ook voor bij ongeveer de helft van de pasgeboren en vooral te vroeg geboren baby’s. Dit komt omdat de lever nog niet voldoende ontwikkeld is. Vrijwel altijd ontwikkelen de kleine levers nog door, waardoor de geelzucht vanzelf weer verdwijnt. Uit een ruwe schatting van de Nederlandse Vereniging van Kindergeneeskunde blijkt dat bij ongeveer twee tot vijf procent van de kinderen er zoveel bilirubine in het bloed zit dat zij een behandeling nodig hebben. Meestal is dit een lichttherapie voor enkele dagen. De golflengte van blauw licht zet bilirubine om in wateroplosbare stoffen, waardoor het lichaam het toch kan uitscheiden.
Erfelijke geelzucht is zeldzaam
Bij erfelijke geelzucht, de ziekte van Crigler-Najjar genoemd, is er een genetische fout waardoor het enzym voor de afbraak van bilirubine niet werkt. Je lichaam kan er niet zelf vanaf komen; lichttherapie is het hele leven nodig. Zo’n dertig patiënten in Nederland hebben hier last van, schat Bosma. Hij probeert nu dit enzym weer aan te vullen door een gezond gen in de levercellen te brengen. De studie voert hij uit samen in samenwerking met Ulrich Beuers, maag-, darm- en leverarts bij het AMC.
Crigler-Najjar is een zeldzame erfelijke aandoening: de kans dat je ermee geboren wordt is ongeveer een op een miljoen. Dat maakt een standaard klinische studie onmogelijk. “Dan heb ik meer patiënten in mijn onderzoek nodig dan er bestaan”, zegt Bosma. Hij behandelt daarom eerst één patiënt. “We wachten af of er niks geks gebeurt en gaan dan de tweede en later de derde patiënt behandelen. Daarna hogen we de dosis wat op en testen we nog drie patiënten. Met de beste dosis behandelen we de overige elf patiënten.”
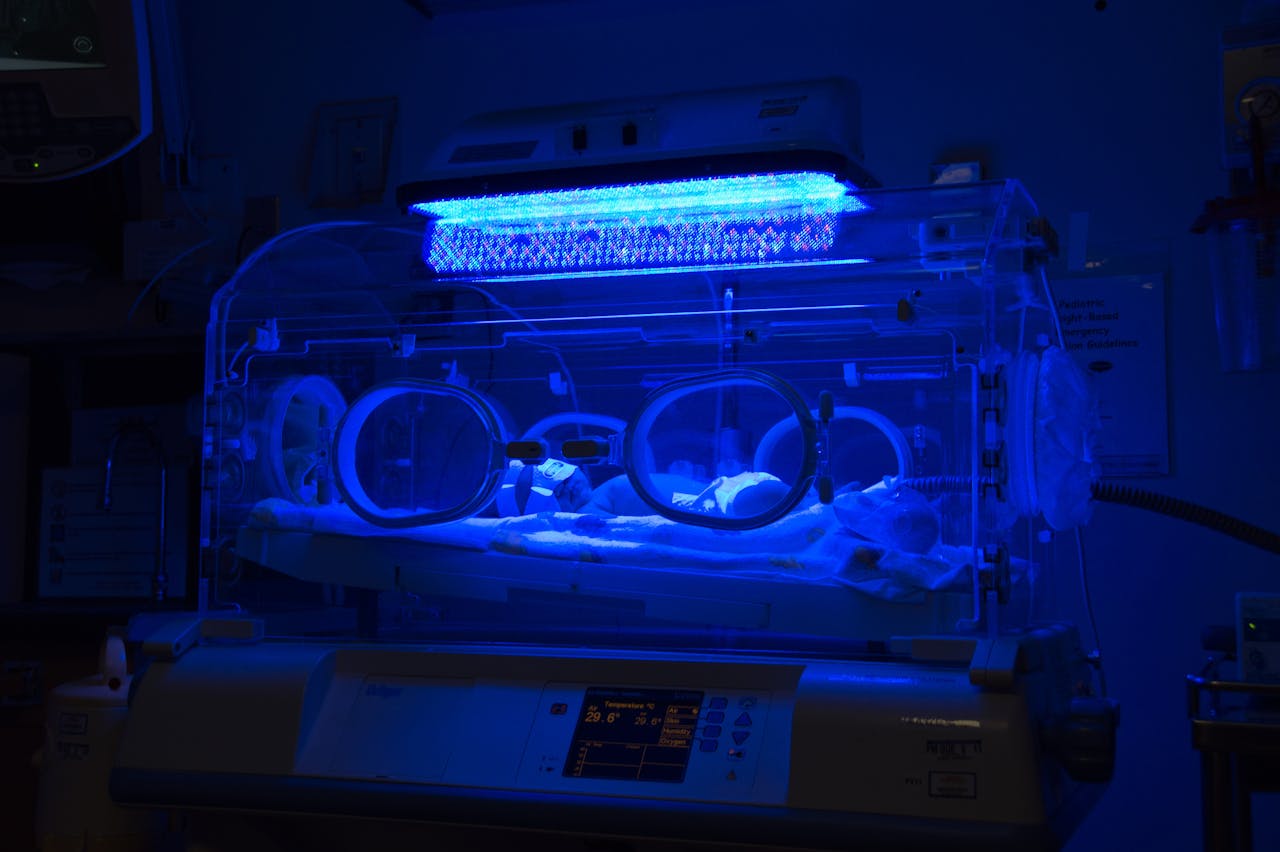
Veel baby’s zien vlak na hun geboorte geel, vooral als de baby te vroeg is geboren. Dit komt door een afvalstof van de rode bloedcellen die de lever niet goed kan afbreken. Blauw licht helpt de gele stof afbreken.
CC BY-NC 2.0 Breity via FlickrGentherapie tegen kostprijs
Zelfs het behandelen van zeventien patiënten is voor Nederland alleen niet haalbaar. Daarom voert het AMC deze studie uit samen met Frankrijk, Italië en Duitsland. Naast dat er weinig patiënten zijn om te onderzoeken, staan de farmaceuten ook niet te springen om een behandeling te ontwikkelen. “Het is geen interessant verdienmodel”, zegt Bosma. De ontwikkeling kost klauwen met geld, “en na één behandeling is de patiënt in principe genezen.” Hoewel de zorgkosten voor erfelijke ziekten velen malen hoger liggen dan de kosten die nodig zijn om een behandeling te ontwikkelen, wordt dit door de overheid nog onvoldoende gestuurd, vertelde Gerard Wagemaker eerder aan biotechnologie.nl.
Voor de bekostiging van deze behandeling heeft Bosma contact gezocht met Généthon, een internationale samenwerkingsorganisatie in Frankrijk. “Zij hebben geld opgehaald om een behandeling te kunnen bieden voor erfelijke ziektes. Ze hebben daarmee zelfs een eigen productiefaciliteit kunnen oprichten en willen nu deze gentherapie leveren tegen de kostprijs.”
In Amerika heeft een farmaceutisch bedrijf, Audentes, wel financiering gevonden voor de gentherapie. Daar startte een jaar geleden de eerste patiënt met erfelijke geelzucht een zelfde soort gentherapie. “De eerste patiënt had tijdelijk verbetering”, laat Bosma weten. “Wij gebruiken een ander construct en een hogere dosis en hopen zo wel een blijvende verbetering te zien.”
Virus brengt gen naar de lever
De patiënt in de trial van Bosma krijgt een nieuw gen in zijn levercellen. Het gen is een gezonde variant van het gen dat nodig is om de geelkleurende bilirubine af te breken. Dit wordt niet ingebouwd in het genoom, want daar kleven risico’s aan. “Het is wel eens gebleken dat je hiermee een onco-gen aanzet”, hierdoor kun je kanker krijgen. In plaats daarvan komt het gen in de celkern, via een injectie van een virus dat onschadelijk is gemaakt. Daarbij blijft alleen het omhulsel over, waarin het gezonde gen wordt geplaatst. Het virus injecteert zijn genetisch materiaal in de celkern en levert zo het nieuwe gen af.
Voor erfelijk leverfalen is gentherapie een hoopvolle uitkomst, maar dat geldt niet voor elke leverziekte. De reden hiervoor is dat de gentherapie niet alle levercellen bereikt. Daardoor ontstaat er een lage concentratie van het enzym, maar voor de bilirubine-afbraak lijkt dat geen probleem. “Als we zo’n vijf procent van de levercellen weten te bereiken, is dat voor Crigler-Najjar-patiënten genoeg”, weet Bosma.
In een keer goed
De toediening van het nieuwe gen moet wel in één keer goed gaan. Als je lichaam eenmaal in aanraking is geweest met het virus dat het gen naar binnen brengt, gaat het afweerstoffen maken. Komt je lichaam voor de tweede keer in aanraking met het virus, dan valt je afweersysteem het virus aan. Het werkt hetzelfde als bij een vaccinatie: de eerste keer leert je lichaam het virus herkennen, de tweede keer gaat het direct in de aanval.
Na een paar maanden, als de therapie lijkt aan te slaan, gaan de patiënten naar het ziekenhuis om daar in een gecontroleerde omgeving de lichttherapie af te bouwen. In de hoop daarna thuis of op vakantieadressen nooit meer in de blauwe schijnwerpers te slapen. Het gaat ongeveer twee jaar duren voor we weten of de therapie voldoende aanslaat, eind 2020 verwachten de onderzoekers hun patiënten te hebben behandeld.