Dat een Chinese genetisch gemanipuleerde tweeling mogelijk eerder zou sterven door een gen-aanpassing klopt niet. Nature Medicine trekt de studie die dat beweerde terug.
Het was groots nieuws in juni 2019: ‘s werelds eerste genetisch gemanipuleerde baby’s zouden mogelijk korter leven dóór die genetische aanpassing. Dat publiceerden onderzoekers van de Berkeley Universiteit van California in wetenschappelijk tijdschrift Nature Medicine. In een Brits bevolkingsonderzoek bekeken zij bijna een half miljoen DNA-profielen en kwamen erachter dat de mensen die de genetische aanpassing al van nature in hun DNA hadden, een grotere kans hadden om voor hun 76e levensjaar te overlijden.
Alleen hebben de onderzoekers, evolutionair bioloog Xinzhu Wei en populatie geneticus Rasmus Nielsen, hun publicatie begin oktober teruggetrokken. Er bleek een fout te zitten in hun onderzoeksopzet en zij konden hun uitkomsten niet reproduceren. “Ik voel dat ik de verantwoordelijkheid heb om dingen recht te zetten voor het publiek,” zegt Rasmus Nielsen in een nieuwsbericht op de site van Nature.
“Iedereen kan een fout maken”, zegt Harold Snieder, genetisch epidemioloog aan de Rijksuniversiteit Groningen, in reactie op deze kwestie. Hij is zelf niet bij het onderzoek betrokken. “Het was alleen gênant dat hun publicatie veel in de media kwam. Maar het is wel eerlijk dat zij hun fout toegeven.”

Biofysicus Jiankui He verkondigde in november 2018 dat hij het DNA van een tweeling had bewerkt.
YouTube, The He labOphef over een tweeling
Een pijnlijke wetenschappelijke misser dus. Om te begrijpen wat er is gebeurd moeten we eerst terug naar 27 november 2018. Op die dag zette de Chinese biofysicus Jiankui He van de Universiteit in Shenzhen een filmpje online waarin hij de geboorte van een tweeling aankondigde waarvan hij het DNA had aangepast. Hun vader had namelijk aids en He wilde voorkomen dat de kinderen besmet konden raken. Toen de baby’s nog embryo’s in een lab waren, had He daarom geprobeerd hen een zogenaamde delta-32-mutatie te geven op hun CCR5-gen. Deze mutatie komt van nature veel voor in Europa. Mensen die drager zijn, kunnen niet besmet raken met hiv.
De wetenschappelijke wereld reageerde furieus op deze boodschap van He. Men vond het niet verantwoordelijk wat hij gedaan had. Er is nog veel te weinig bekend over de gevolgen van een DNA-aanpassing bij embryo’s en ook is er nog onvoldoende informatie over de veiligheid van de CRISPR-Cas9-technologie, waarmee hij het DNA bewerkte.
Waarschijnlijk is het Jiankui He niet eens gelukt om de tweeling precies de delta-32-mutatie te geven. Naar verwachting ligt de mutatie elders in hun CCR5-gen, maar He heeft daar nooit wetenschappelijk over gepubliceerd. Toch werden daarna alle nieuwe feiten over het CCR5-gen breed uitgemeten in het nieuws: de twee kinderen zouden door de CCR5-mutatie vatbaarder zijn voor het West-Nijlvirus, ze zouden wat intelligenter zijn en sneller herstellen na een beroerte. Het was daarom niet zo gek dat de studie over de CCR5-mutatie en een lagere levensverwachting ook veel in de media kwam.
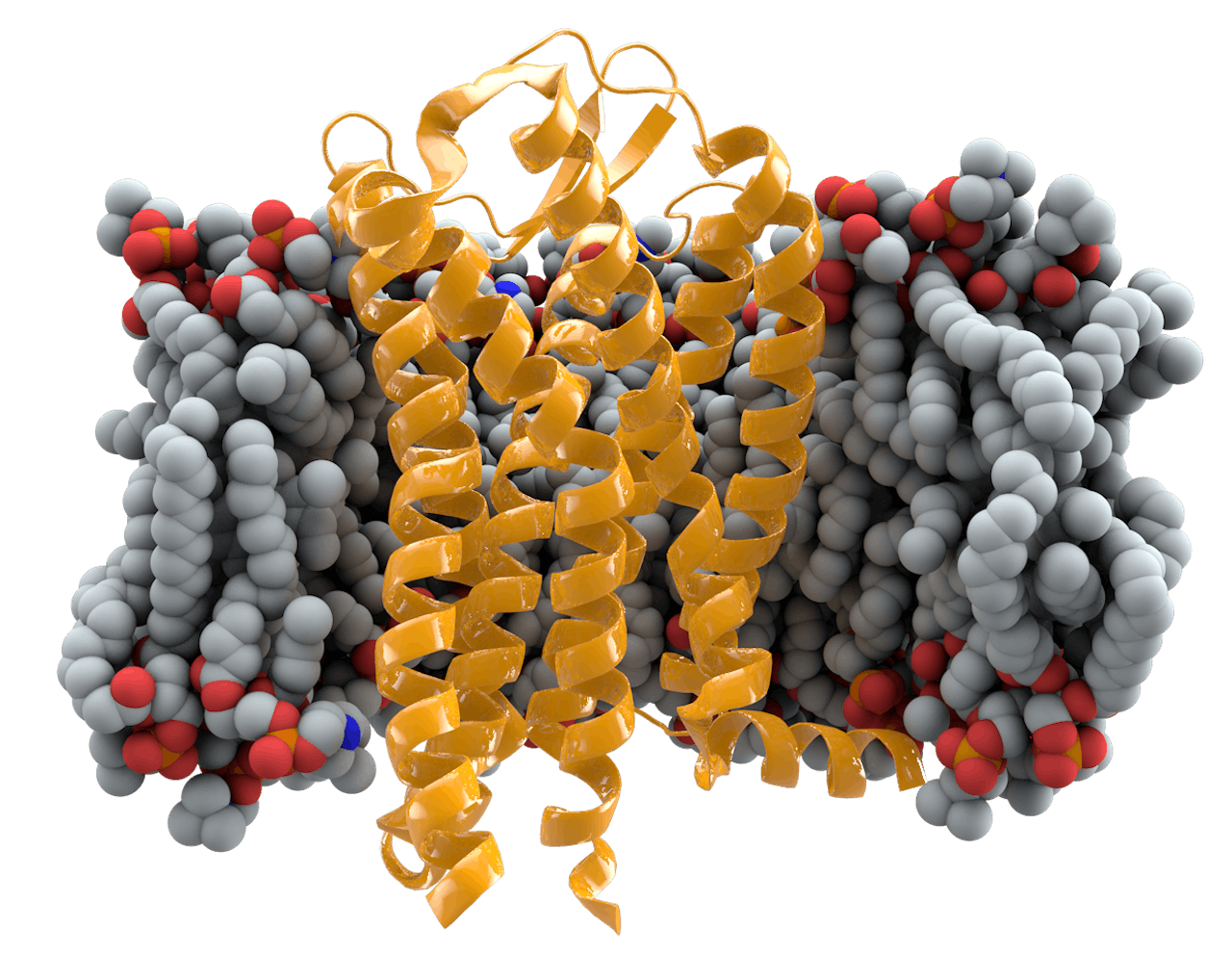
Het CCR5-gen zorgt ervoor dat cellen receptoren (in geel) aanmaken in hun celmembraan (grijs). Hiv-virussen kunnen zich binden aan die receptor en zo de cel besmetten. Mensen met een delta 32-mutatie op hun CCR5-gen maken de receptoren niet aan en zijn dus resistent tegen hiv-besmetting.
Door Thomas Splettstoesser (www.scistyle.com) - CC BY-SA 3.0, WikipediaGeen hiv, wel eerder dood
Wat hadden de Californische onderzoekers nu precies gevonden? Op basis van 410.000 DNA-profielen uit een Brits bevolkingsonderzoek (de UK Biobank) concludeerden zij dat mensen die de CCR5-mutatie van hun beide ouders geërfd hebben, 21 procent kans hebben om voor hun 76ste levensjaar te overlijden. Een verklaring waarom dit gen gepaard zou gaan met een korter leven, konden de onderzoekers niet geven.
Al waren Wei en Nielsen zich ervan bewust dat de Chinese tweeling mogelijk net een andere mutatie had, toch zagen ze hun uitkomst als bewijs dat er gevaar kleeft aan het bewerken van embryonaal DNA. “Dit onderstreept het idee dat het maken van genetische mutaties bij mensen met behulp van CRISPR-Cas (…), een aanzienlijk risico inhoudt”, schrijven ze in hun publicatie. “Zelfs als de mutaties voordelig lijken te zijn.”
Wetenschappelijke controle
Na publicatie stuitte hun conclusie vrij snel op scepsis bij vakgenoten. Verschillende internationale onderzoekers bogen zich over hun werkwijze en conclusie. Eén daarvan is populatie-geneticus David Reich van Harvard Medical School in Boston. Die heeft, samen met Wei en Nielsen, hun eigen studie nog eens grondig over gedaan.
Al gauw bleek wat er was misgegaan. Toen Nielsen en Wei de duizenden DNA-profielen onderzochten op het voorkomen van de natuurlijke mutatie in het CCR5-gen maakten ze gebruik van een zogeheten ‘marker’. Dat is een stukje DNA dat vlakbij de mutatie ligt en dat samen met de mutatie overerft van ouder op kind. Maar doordat de CCR5-mutatie bestaat uit een deletie – er mist een stuk DNA – werd die marker niet bij alle individuen in de UK Biobank gezien. “Ze hadden moeten controleren of de marker die ze gebruikten goed was en dat hebben ze niet gedaan”, zegt Snieder. “Dit soort fouten zijn wel bekend. Je moet heel voorzichtig zijn dat de markers van goede kwaliteit zijn.”
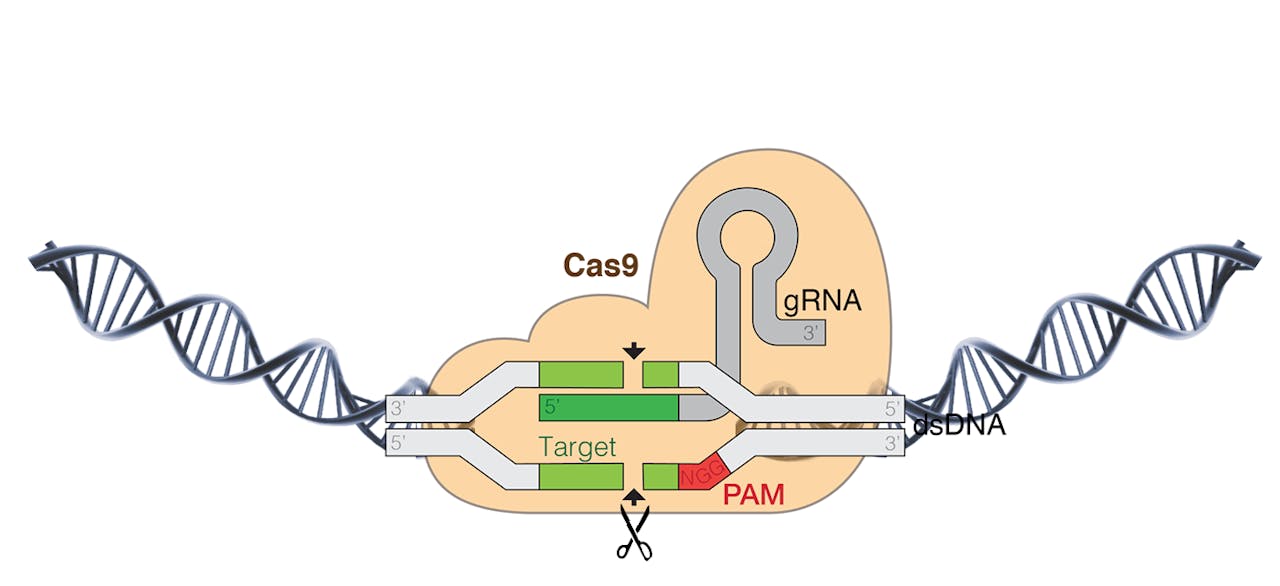
Cas9 gaat met het gids-RNA (grijs) op zoek naar het passende stukje DNA. Wanneer dit past knipt Cas9 het DNA door. Om Cas9 te laten binden moet er direct naast het passende DNA een essentiële code zitten (rood). Voor SpCas9 moet dat eindigen op ‘GG’, voor ScCas9 op ‘G’.
Wikimedia Commons, Marius Walter, bewerkt door KennislinkDaarnaast kwam recent pas de complete DNA-volgorde vrij van tien procent van de populatie in de UK Biobank. Toen Reich, Nielsen en Wei die complete DNA-profielen bekeken bleek nogmaals dat zij hun marker niet goed gekozen hadden. Ook konden ze er geen grond vinden waarop ze konden concluderen dat de CCR5-mutatie samenvalt met levensduur. Snieder: “Het was dus alleen op toeval gebaseerd dat hun eerdere uitkomst gerelateerd was met een kortere levensduur.”
IJslandse en Finse onderzoekers deden hetzelfde onderzoek van Nielsen en Wei nog eens over, in hun eigen nationale biobanken. Zij vonden de relatie tussen de CCR5-mutatie en leeftijd ook niet.
Een wetenschappelijke fout dus, waardoor het niet meer te zeggen is of de Chinese CRISPR-baby’s een korter leven te wachten staat. Goed nieuws? Snieder: “Het aanpassen van menselijk DNA is eigenlijk een aparte discussie. Maar de wetenschap houdt die discussie niet voor niets. We weten niet wat we ermee veroorzaken.”