Gene drive is een biotechnologische techniek die dé oplossing belooft te zijn voor ziektes die door insecten worden overgebracht. Met gene drive behoren denguekoorts en malaria straks tot het verleden, zo is de gedachte.
Als zowel Nature als Science vol staan over één onderwerp, dan kun je er vanuit gaan dat er ‘iets groots’ aan de hand is. In 2002 stonden alle grote wetenschappelijke tijdschriften vol over malaria: omdat het DNA van zowel de mug als de malariaparasiet toen was gekraakt, was volgens de vakbladen een oplossing voor malaria (nog altijd goed voor 400.000 doden per jaar) binnen handbereik. Recenter, in 2014, klonk de loftrompet nogmaals: nu we de boosdoeners genetisch konden uitschakelen, zou er een einde kunnen komen aan malaria. Maar vandaag de dag is malaria er nog steeds… We vroegen prof. dr. ir. Willem Takken, entomoloog aan het Wageningen University & Research, en al meer dan 25 jaar op zoek naar manieren om malaria te bestrijden, om opheldering.
Waarom is malaria zo’n lastpak?
“Om te begrijpen waarom malaria zo’n lastig te bestrijden ziekte is, moet je meer weten van de ecosystemen waar malariamuggen deel van uitmaken. Wat we de afgelopen eeuw hebben gezien, is dat malariamuggen ongelooflijk goed bestand zijn tegen maatregelen die we nemen. In Europa hadden we vroeger malaria, maar een combinatie van insecticiden, voorlichting bij de bevolking en goede medische zorg hebben malaria uit Europa verdreven. Daarvóór waren er alleen al in Griekenland vier miljoen patiënten per jaar. Bestrijding ging niet makkelijk, en de kans dat dat in de tropen op dezelfde manier zou lukken zijn uiterst klein. Malariamuggen zijn negentig procent antropofiel. Dat wil zeggen dat wij mensen als bron van bloed buitengewoon favoriet bij ze zijn. Bovendien houden ze van een schaduwrijke, waterrijke plek. In landbouwgebieden creëren we de ideale verblijfplaats voor ze.”
We maken het ze dus makkelijk.
“In zekere zin, ja: ze zijn erg ingespeeld op de manier waarop we in ons voedsel voorzien. Je kunt moeilijk zeggen: stop maar met landbouw. Dus wordt er op tal van manieren geprobeerd de malariamug te slim af te zijn.”
Welke conventionele manieren zijn succesvol?
“Er is inmiddels een vaccin, maar dat geeft dertig procent dekking. Voorlichtingsprogramma’s en ontwikkelingshulp hebben ervoor gezorgd dat zeventig procent van de Afrikaanse bevolking inmiddels onder een klamboe slaapt. En we hebben zelf onderzoek gedaan naar het effect van verspreiden van geurstoffen die synoniem zijn met die van de mens. Zo breng je de muggen letterlijk op een dwaalspoor. In gebieden waar we dat deden, nam het aantal besmettingen in een jaar tijd met dertig procent af. Het lastige is, dat geen enkele van die middelen afdoende is.”
Geldt dat ook voor de meer biotechnologische middelen?
“Soms zijn die buitengewoon succesvol. De meest eenvoudige is de steriele insecten-techniek. Daarbij wordt een populatie gedecimeerd of zelfs uitgeroeid door ze te vermengen met steriel-gemaakte mannetjes. Vroeger gebeurde dat steriliseren vooral met bestraling, maar dat had als nadeel dat die mannetjes vaak al half kreupel door de straling werden vrijgelaten. Daardoor waren ze veel minder dan niet-behandelde mannetjes in staat om te paren, en zodoende was deze bestrijdingsmethode niet zo effectief als je zou willen. Nu worden die mannetjes genetisch gemanipuleerd met een gen dat in het nageslacht ervoor zorgt dat het niet levensvatbaar is. Er zijn kwekerijen waar miljoenen mannetjes per week worden opgekweekt. En dat heeft succes. Een beroemd voorbeeld is dat Khadaffi in 1988 een stier cadeau kreeg van een Midden-Amerikaans land. Die stier bleek besmet met de screwworm fly, die op het Amerikaanse continent voor veel problemen bij vee zorgt, maar elders niet voorkomt. Om een grootschalige uitbraak te voorkomen nadat de stier in Libië zou arriveren, is toen met behulp van steriele mannetjes de verspreiding van de screwworm fly voorkomen. Een half jaar lang 3,5 miljoen steriele mannetjes per week loslaten bleek voldoende. Vorig jaar heeft de Cogem positief geadviseerd om deze techniek op het Bovenwindse Eiland Saba in te zetten tegen dengue (knokkelkoorts). Je brengt wel genetisch gemodificeerde organismen in de natuur, maar dat vormt eigenlijk geen risico, omdat ze er maar kort zijn en zich niet kunnen voortplanten.”
Waarom werkt deze techniek niet bij malaria?
“Allereerst omdat malaria wordt veroorzaakt door een parasiet die op verschillende muggensoorten meelift. Eén muggensoort met steriele mannetjes terugdringen heeft dus niet zoveel zin, want dan ontwikkelt de andere soort zich bij gebrek aan concurrentie beter. Verder is er het probleem van omvang: een eiland als Saba gaat nog wel, maar een heel Afrikaans continent op die manier aanpakken; da’s niet te doen.”
De meest recente ontwikkeling waar veel van verwacht wordt is ‘gene drive’; hoe werkt dat?
“Met ‘gene drive’ breng je in het DNA van een malariamug met behulp van bijvoorbeeld Crispr-CAS een gen (een klein stukje DNA dat zorgt voor een erfelijke eigenschap) in, dat de mug ongevoelig maakt voor de parasiet Plasmodium falciparum. Als een mug resistent wordt tegen de parasiet, dan kan die hem ook niet meer overbrengen op mensen. Maar aan één resistente mug heb je niet zoveel. Als je wilt dat alle parasieten uit de muggenpopulatie verdwijnen, moet je zorgen dat álle muggen resistent worden. Daar is een ander trucje voor: behalve een gen wordt ook een ‘kopieerapparaat’ ingebouwd, dat ervoor zorgt dat de resistente mug het ingebouwde gen ook aan al zijn of haar nakomelingen doorgeeft. En die nakomelingen weer aan diens nakomelingen. En na een aantal generaties zijn op die manier steeds meer muggen resistent. Dat ‘kopieerapparaat’ heet ‘gene drive’.”
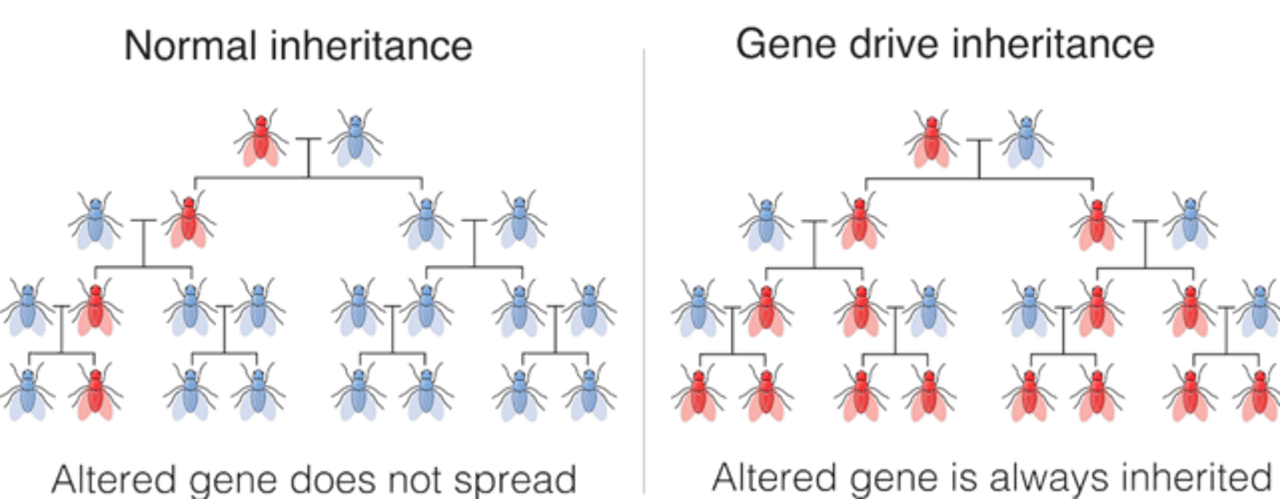
Het verschil tussen het verspreiden van een eigenschap in een populatie zónder gene drive (links) en mét (rechts). Doordat bij een kruising normaliter slechts de helft van de nakomelingen het gewenste gen krijgt, verspreid dat gen en de erbij horende eigenschap maar moeizaam door de populatie. Gene drive zorgt ervoor dat álle nakomelingen het gen erven. Daardoor verspreidt de eigenschap zich veel meer in de populatie.
Marius Walter, CC by-sa 4.0 via Wikimedia CommonsJe laat dan dus de resistentie tegen de parasiet via een klein aantal muggen in de muggenpopulatie invoeren, en na verschillende generaties is de hele populatie ongevoelig geworden voor de parasiet.
“Dat is het idee. Maar er zijn verschillende redenen waarom gene drive problematisch is. Er is het principiële bezwaar: je mengt je in de evolutie. Ik denk zelf niet dat er hele ecosystemen zullen omvallen omdat een aantal muggensoorten een extra gen hebben, maar in 2000 is wel afgesproken in het Cartagena Protocol voor bioveiligheid dat je vooraf moet weten wat de gevolgen van zo’n interventie zijn voor het ecosysteem. Daarom worden er nu in Kenia, Burkina Faso en Malawi proeven gedaan in grote kassen, hermetisch afgesloten van de buitenwereld, en in een omgeving waarin de muggen sowieso niet zouden overleven. Los van die eventuele invloed op ecosystemen zijn er veel praktische problemen: muggen die in het lab zijn uitgerust met gene drive blijken minder fit te zijn dan soortgenoten uit het wild. Ze zijn veel gevoeliger voor negatieve omgevingsfactoren en produceren minder nakomelingen. Hoeveel respect ik ook heb voor moleculair-biologen, het blijkt gewoon heel moeilijk om met gene drive een stabiele, gezonde mug te maken. Daarnaast speelt ook dat malaria bijna nergens door maar één soort wordt overgebracht. Er zijn nu wel in het lab Anopheles gambiae_-muggen met gene drive ongevoelig gemaakt voor de parasiet, maar tegen de _Anopheles funestus – een andere veel voorkomende Afrikaanse malariamug – bestaat er nog niets.”
Als we dat bekijken vanuit een rooskleurig standpunt, zijn dat soort praktische problemen dan eerder kinderziektes dan absolute no-go’s?
“Sommige van die kinderziektes blijken hardnekkig. Maar zelfs als ze overwonnen worden, dan nog zijn er een paar andere problemen. Malariamuggen zijn schadelijk omdat ze de parasiet kunnen overbrengen. Maar ze zijn óók schadelijk, omdat ze bijvoorbeeld ziektes als o’nyong nyongkoorts en de olifantsziekte (elefantiase – een door wormpjes veroorzaakte aandoening aan het lymfestelsel) overbrengen. Als je nu de kans op een besmetting op malaria enorm gaat verkleinen, loop je wel het risico dat het aantal klamboes in Afrika weer afneemt, en je eigenlijk van de regen in de drup komt. Verder is het idee om, als het er al van komt, eerst kleinschalig te beginnen. Sao Tomé, een eiland voor de kust van Gabon, of Zanzibar (een eiland bij Tanzania) zijn als proeftuin geopperd. Mocht er dan iets onverwachts uitkomen, dan zijn de gevolgen minder groot.”
Wat vindt u van de claims dat malaria door technologie x of technologie y bestreden kan worden?
“In theorie kan het. Maar in de praktijk zou ik nooit al mijn geld op gene drive inzetten. Biotechnologie is niet zaligmakend, maar het kan zeker wel bijdragen tot een oplossing. Ik zou ook niet alles inzetten op de synthetische mensengeur. Eigenlijk zie je bij al die interventies, dat een combinatie van interventies het best werkt. Waar we nu het meest mee kunnen winnen, is denk ik het ontwikkelen van de natuurlijke vijanden die malariamuggen al hebben: schimmels, bacteriën en virussen. Het grote voordeel van die vijanden, is dat we weten dat ze werken: ze zijn al succesvol gebleken. Het nadeel is, dat hun succes vaak heel lokaal is. Je zou het dus lokaal moeten toepassen, en dat maakt het heel veel werk.”

