De strijd om te overleven dwingt bacteriën tot slimme oplossingen. Zoals het ontwikkelen van een enzym dat niet een, maar drie verschillende producten kan maken, zo ontdekten Duitse onderzoekers. Opmerkelijk, want enzymen voeren normaal gesproken heel specifiek één reactie uit.

Somalische piraten hebben een Chinese vissersboot overmeesterd in de Indische Oceaan, november 2008.
Jason R. Zalasky via Wikimedia Commons, publiek domeinPiraterij is niet alleen een bedreiging voor de zeevaart, ook voor bacteriën is het een reëel gevaar. Het gaat dan om ‘ijzerpiraterij’ – het verschijnsel dat bacteriestammen actief proberen het ijzer voor elkaars neus weg te kapen. IJzer is van levensbelang omdat het onder meer eiwitten die betrokken zijn bij opname en transport van zuurstof goed laat functioneren.
De strijd om het ijzer heeft ertoe geleid dat bacteriën specifieke stoffen ontwikkelden waarmee ze ijzer uit hun omgeving absorberen. Dit zijn de zogeheten sideroforen, afgeleid van het Grieks voor ‘ijzerdragers’. Sommige hebben nog meer nuttige functies dan het binden van ijzer.
In 2014 publiceerden biochemicus Thomas Böttcher van de Universiteit van Konstanz (Duitsland) en collega’s dat de mariene bacterie Shewanella algae een siderofoor uitscheidt die voorkomt dat een concurrerende bacterie, Vibrio alginolyticus, zwermen vormt. Bacteriën die zwermen vormen kunnen zich gezamenlijk sneller en over grotere afstanden verplaatsen. Beide bacteriën leven in dezelfde omgeving. Door het zwermgedrag van V. alginolyticus te blokkeren, creëert S. algae meer ruimte voor zichzelf. Een interessante vondst, omdat zwermen bacteriën vaak veel ongevoeliger zijn voor antibiotica. Als je dat zwermgedrag blokkeert, kun je misschien deze bacteriën alsnog bestrijden.
Asymmetrisch
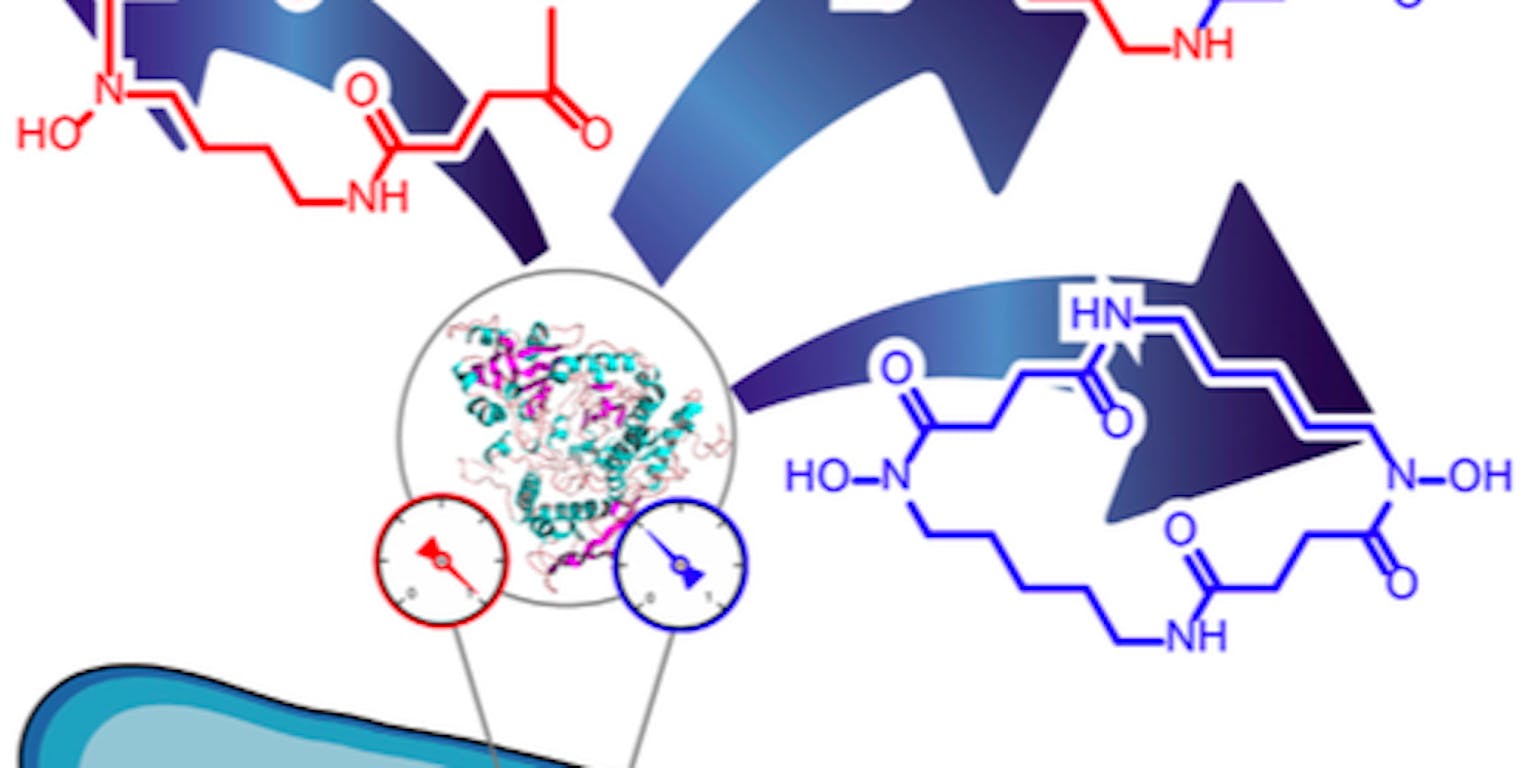
Maar de siderofoor in kwestie, genaamd avaroferrine, is niet alleen interessant vanwege die blokkerende eigenschap. Ook de ringvormige structuur van het molecuul is opvallend. Er zijn veel verschillende sideroforen bekend, maar tot nu toe zijn er slechts vier gevonden met een ringvormige structuur. Drie daarvan zijn symmetrisch: de ring bestaat uit twee identieke delen. Avaroferrine is als enige asymmetrisch. Hier zijn twee verschillende bouwstenen aan elkaar gekoppeld tot een ring.
S. algae produceert drie van deze ringvormige sideroforen: putrebactine, avaroferrine en bisucaberine in de verhouding 1:2:1. Avaroferrine is een mengvorm van de andere twee. Uit twee basisbouwstenen weet S. algae dus drie verschillende sideroforen te maken. Böttcher vroeg zich af hoe de bacterie dat doet en welke factoren de productieverhouding bepalen. In Cell Chemical Biology beschrijven hij en collega’s nu dat slechts één enzym, AvbD, verantwoordelijk is voor de biosynthese van alle drie de sideroforen. Dat is opvallend, omdat we in alle biochemieboeken lezen dat enzymen zo bijzonder zijn vanwege hun hoge specificiteit. Ze katalyseren één reactie en doen dat heel erg goed. Maar AvbD katalyseert er dus drie.
Dit werpt meteen andere vragen op, want normaal gesproken reguleert een cel de biosynthese van verschillende stoffen op genetisch niveau. Als stof X meer nodig is, wordt het gen dat codeert voor het bijbehorende enzym X ‘opgereguleerd’. Maar in dit geval kan dat niet, want er is maar één enzym. Als je die harder laat werken, krijg je meer van alle drie de stoffen. Dus hoe reguleert S. algae dan de productieverhouding tussen de drie sideroforen?
Stuwmeer
Die vraag werd nog interessanter toen bleek dat AvbD in geïsoleerde vorm, dus buiten de cel, een sterke voorkeur heeft voor de productie van bisucaberine, de grootste van de drie sideroforen. Echter, in de intacte bacterie wordt twee keer zoveel avaroferrine geproduceerd als respectievelijk bisucaberine en putrebactine. Het blijkt dat S. algae de controle over de productie uitoefent via de voorraad van de twee bouwstenen. Door daar verschil in aan te brengen, kan de bacterie de onderlinge verhouding sturen. AvbD werkt het liefst met cadaverine, de bouwsteen van bisucarberine. Door het niveau van de andere bouwsteen, putrescine, heel hoog te houden creëert S. algae een soort stuwmeer dat druk uitoefent en het proces richting de productie van avaroferrine duwt. Simpel gezegd: doordat er steeds veel putrescine voorhanden is, ontkomt AvbD niet aan de productie van avaroferrine en putrebactine.
Böttcher en zijn team concluderen dat de manier waarop S. algae de productie van de sideroforen controleert en stuurt een mooi voorbeeld is van een slimme evolutionaire strategie die de bacterie in staat stelt om met minimale inspanning maximaal resultaat te bereiken. En bovendien flexibiliteit meebrengt; de bacterie kan heel snel inspelen op veranderingen in de omgeving door de productieverhouding aan te passen.
Ze komen ook met een waarschuwing voor iedereen die wil onderzoeken welke stoffen een bacterie of ander organisme van nature maakt. Door alleen te kijken naar geïsoleerde enzymen kun je een vertekend beeld krijgen. Analyse van de processen in de intacte cel is vereist om zeker te weten wat een organisme zoal produceert. Er is volgens hen namelijk geen enkele reden om aan te nemen dat alleen S. algae deze productiestrategie met een multispecifiek enzym heeft ontwikkeld.