Het succes van vaccinaties berust op de vorming en het behoud van geheugencellen. Helaas zijn er niet altijd voldoende van deze cellen. Dat is afhankelijk van de stofwisseling. Immunologe Rianne van der Windt is op zoek naar een stofje dat de vorming van geheugencellen stimuleert. Met als doel om vaccins te verbeteren.
Op het moment dat een ziekteverwekker je lichaam binnenkomt, komt het afweersysteem in actie. Er snellen allerlei afweercellen naar de plek van het onheil om de binnendringer zo vlug mogelijk onschadelijk te maken. Als dat gelukt is, zijn de afweercellen op dat moment niet meer nodig en gaan de meesten dood. Slechts een fractie overleeft. Dit zijn de geheugen T-cellen. Bijzondere afweercellen, die onthouden wat ze gezien hebben. Bij een volgende aanval van dezelfde ziekteverwekker kunnen deze geheugencellen heel snel reageren. Zo snel dat je er meestal niet eens ziek van wordt.
Gevoelige muizen
De werking van vaccinaties berust op de vorming van geheugencellen. In een vaccin zitten stukjes eiwit van de ziekteverwekker waar het middel tegen gericht is. Ons afweersysteem reageert op die lichaamsvreemde stukjes eiwit en komt dus in actie. Na het opruimen van de stukjes eiwit ontstaan geheugencellen. Die kunnen, op het moment dat ze in contact komen met de echte ziekteverwekker, het afweersysteem snel een seintje geven om weer aan de slag te gaan.
Helaas ontstaan geheugencellen niet altijd en dat is ook de reden dat vaccinaties soms niet of niet goed werken. In 2009 ontdekte de Amerikaanse immunologe Erika Pearce voor het eerst dat de stofwisseling daarbij een belangrijke rol speelt. Pearce zag dat muizen die de signaalstof TRAF6 missen gevoelig zijn voor infecties, omdat zij nauwelijks geheugencellen aanmaken. Zij isoleerde de afweercellen van deze muizen en vergeleek ze met de afweercellen van gezonde muizen. Met een verrassend resultaat. De afweercellen van muizen die TRAF6 missen worden geen geheugencellen omdat zij een defect hebben in de verbranding van vetzuren.
Veel mitochondriën
Immunologe Rianne van der Windt promoveerde in het voorjaar van 2010 op haar onderzoek naar een heel ander deel van het afweersysteem, de snelle afweer, waarbij cellen ontstekingsstofjes aanmaken waarmee bacteriën vlug worden opgeruimd. Zij was gegrepen door het onderzoek van Pearce omdat er over de effecten van stofwisseling op de vorming van geheugencellen vrijwel niets bekend was. Met een Rubicon-subsidie van NWO op zak vertrok zij naar Amerika. Daar probeert ze in de onderzoeksgroep van Pearce te ontrafelen waarom de verbranding van vetzuren essentieel is voor de vorming van geheugencellen en hoe we dat kunnen beïnvloeden. Vanaf juni zet zij met behulp van een VENI-subsidie haar onderzoek voort aan het AMC Amsterdam.
Van der Windt vertelt Kennislink via de telefoon wat ze de afgelopen jaren al ontdekt heeft en wat er nog te ontdekken valt. “Afweercellen met een hoge vetzuurverbrandingscapaciteit veranderen gemakkelijk in geheugencellen. De vetzuurverbranding vindt plaats in mitochondriën, de energiefabriekjes van de cel. Het blijkt dat geheugencellen beter functioneren en meer mitochondriën hebben dan andere T-cellen. Een absoluut aantal is moeilijk te bepalen, maar ik denk dat het ongeveer een factor twee scheelt.”
En dat hoge aantal mitochondriën zorgt ervoor dat geheugencellen veel langer kunnen overleven dan andere T-cellen. De meeste afweercellen gaan dood direct nadat een infectie is opgeruimd, maar geheugencellen kunnen wel een paar jaar oud worden. Dat is handig, omdat de kans dat zij dezelfde ziekteverwekker in een paar jaar tijd nog een keer tegenkomen een stuk groter is dan wanneer zij slechts enkele dagen of weken zouden leven.
Flexibele cellen
De vraag blijft hoe meer mitochondriën ervoor zorgen dat een geheugencel langer leeft. Wetenschappelijk bewijs is er nog niet, maar van der Windt heeft daar wel zo haar idee over. “Veel mitochondriën zorgen ervoor dat de geheugencel flexibel is. Tijdens de piek van een infectie gebruiken de meeste T-cellen suikers als brandstof. Die suikers kunnen ze opnemen door de aanwezigheid van ontstekingsstofjes. Als de infectie wordt opgeruimd, raken die ontstekingsstofjes ook een keer op en kunnen de cellen suikers niet meer in grote hoeveelheden opnemen. Cellen die op dat moment niet kunnen omschakelen naar een andere brandstof, zoals vetzuren, gaan dood.” Doordat zij zoveel mitochondriën hebben, zijn geheugencellen wel in staat om in verschillende situaties te overleven.
Om meer en betere geheugencellen te kunnen krijgen, gaat van der Windt op zoek naar stofjes die het aantal mitochondriën verhogen. Echt ver hoeft ze daarvoor waarschijnlijk niet te zoeken. “Bij andere celtypen zijn al een aantal stofjes bekend die dit effect hebben”, zegt ze. “Bijvoorbeeld het ontstekingsstofje interleukine 15 (IL-15). Ik ben nu bezig deze stofjes te testen op T-cellen met als doel om het aantal cellen dat na de piek van een infectie overleeft te verhogen.”
Het succes van vaccinaties berust op de vorming van geheugencellen. Helaas zijn er niet altijd voldoende van die cellen. Rianne van der Windt is op zoek naar stofjes die de vorming van geheugencellen kunnen stimuleren. Op die manier kunnen vaccins verbeterd worden.
Grook Da Oger, Wikimedia CommonsAls één van de stofjes goed lijkt te werken, opent dat de weg naar een middel dat de vorming van geheugencellen kan stimuleren en zo het succes van vaccinaties kan vergroten. Welke vaccins van der Windt het eerste aan zou willen pakken, weet ze nog niet precies. “Vanzelfsprekend een vaccin dat nog niet beschikbaar is (bijvoorbeeld een vaccin tegen hepatitis c) of dat zwak is in de vorming van geheugencellen (zoals het vaccin tegen tuberculose)” zegt ze.
Aspecifiek
Maar de keuze is niet helemaal onbeperkt. “Ik werk op dit moment met T-cellen die alleen ziekteverwekkers aanvechten die in andere cellen zitten. Dat zijn vooral virussen, maar ook een aantal bacteriën. Parasieten zoals wormen of malaria zitten buiten de cel en worden door een ander type T-cel bestreden.” Of ook die andere soort T-cel verbeterd kan worden door het aantal mitochondriën te verhogen moet nog blijken.
De stofjes die er op dit moment zijn, werken niet specifiek. Ze worden herkend via een receptor, maar die receptor is niet alleen aanwezig bij afweercellen. Ook andere cellen kunnen zo’n stimulerend stofje dus oppikken en van der Windt weet nog niet wat het effect daarvan zal zijn. Dat moet in de komende jaren blijken uit onderzoek.
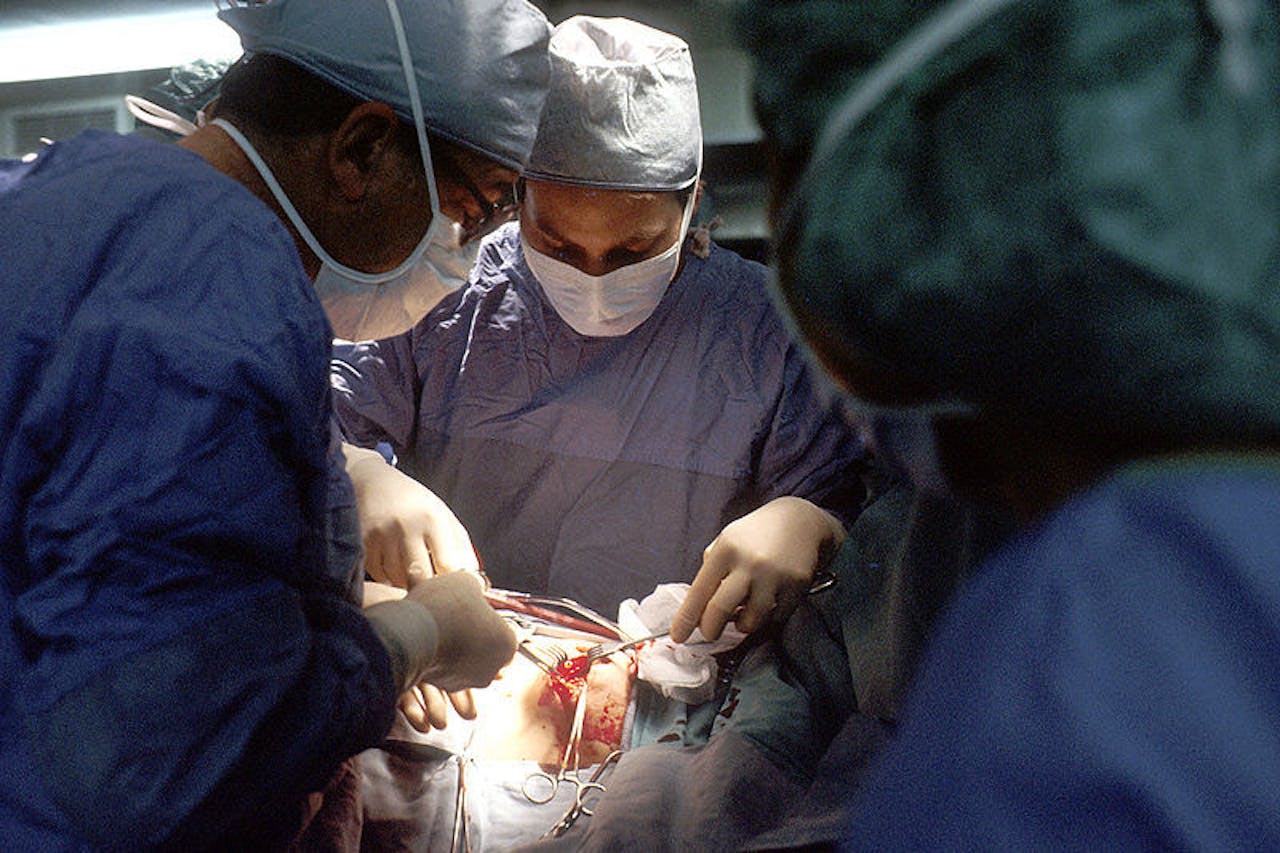
Chirurgen verwijderen tijdens een operatie een stukje borstweefsel voor onderzoek. Omdat afweercellen naar tumoren toe migreren, is de kans groot dat in het verwijderde weefsel ook afweercellen te vinden zijn.
Linda Bartlett, Wikimedia CommonsMocht er een vaccin worden gevonden tegen kanker, dan zal die aspecificiteit mogelijk geen probleem zijn. Afweercellen migreren naar tumoren toe in een poging ze onschadelijk te maken. Als er bij een patiënt tumorweefsel wordt verwijderd, zitten daar dus ook afweercellen in. “Met die afweercellen kun je spelen buiten het lichaam” zegt van der Windt. “Je zou ze kunnen voorbehandelen met een middel dat de vorming van geheugencellen stimuleert voordat je ze teruggeeft aan de patiënt.”
Goed model
Zover is het echter nog lang niet. Daar kan nog wel tien jaar overheen gaan. Van der Windt is pas net begonnen met het testen van de stofjes in kweekschaaltjes. Vervolgens laat zij de afweercellen los op de Listeria bacterie. Een goed modelorganisme waar je makkelijk mee kunt werken, maar nog niet de ziekteverwekker waar het middel uiteindelijk voor bedoeld is.